【题目】有关氧气的说法,正确的是( )
A. 带火星的木条一定能在含有氧气的集气瓶中复燃
B. 工业上可用分离液态空气的方法制氧气属于分解反应
C. 木炭在氧气中的燃烧实验,要把红热的木炭迅速放入集气瓶底部
D. 无色氧气变成淡蓝色的液氧的变化属于物理变化
参考答案:
【答案】D
【解析】A.空气中含有氧气,但氧气的浓度不够,带火星的木条并不能复燃,故A错误;B.工业上分离液态空气的方法制氧气,是物理变化,不属于分解反应,故B错误;C.木炭在氧气中燃烧实验中,要把红热的木炭缓慢放入集气瓶中,以利于木炭与氧气充分接触,故C错误;D.无色氧气变成淡蓝色的液氧,此过程无新物质生成,此变化属于物理变化,故D正确;答案为D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】汽车安全气囊内化学物质能在碰撞后生成一种空气中含量最多的气体,该气体是( )
A. 氧气 B. 稀有气体 C. 二氧化碳 D. 氮气
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习化学可以了解日常生活中某些变化的本质,下列变化中属于化学变化的是
A.冰川融化 B.葡萄酿酒 C.西瓜榨汁 D.玻璃破碎
-
科目: 来源: 题型:
查看答案和解析>>【题目】高铁酸钠是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂.其化学式为Na2FeO4,其中Fe元素的化合价是
A.+6 B.+4 C.+3 D.+2
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列灭火方法不合理的是
A.炒菜时油锅不慎着火,可用水扑灭
B.森林发生火灾,可砍掉部分树木,形成隔离带
C.堆放杂物的纸箱着火,用水浇灭
D.不慎碰到酒精灯,酒精在桌面上燃烧,立即用湿抹布扑盖
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室在进行双氧水制备氧气实验时,某同学不小心将硫酸铜溶液滴加到试管中,发现立即有大量气泡产生,该同学就此对“硫酸铜对过氧化氢溶液的分解是否也有催化作用”的课题进行研究,以下是探究的主要过程:
【提出猜想】硫酸铜可以作过氧化氢溶液的催化剂。
【实验方案】常温下取两瓶H2O2溶液,其中一瓶加入一定量的硫酸铜(另外一瓶不加),测量各生成一瓶(相同体积)O2所需要的时间。
【进行实验】如图所示为进行实验的装置图,此实验中B处宜采用的气体收集方法是____________。
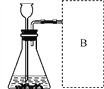
【实验记录】
实验编号
1
2
反应物
6%的H2O2
6%的H2O2
反应物的量/mL
2
2
加入物质名称
不加任何物质
1 g CuSO4
时间/s
270
40
【得出结论】由该实验过程可知硫酸铜溶液对双氧水分解具有催化作用,则该实验过程发生反应的化学方程式为________________________。
【实验反思】实验结束后,小明又对硫酸铜溶液中哪种微粒对双氧水分解产生催化作用产生兴趣(该溶液中有Cu2+、SO
 和H2O),并进行猜想:①可能是水分子;②可能是________;③可能是Cu2+。
和H2O),并进行猜想:①可能是水分子;②可能是________;③可能是Cu2+。小明将此猜想与同学小芳进行讨论,小芳立即否决了猜想①,原因是________________________。
【查阅资料】Na+、NO
 对双氧水的分解没有催化作用,据此小明在实验室里选择了两种试剂进行了实验探究,它们分别为________和________。
对双氧水的分解没有催化作用,据此小明在实验室里选择了两种试剂进行了实验探究,它们分别为________和________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】某化学实验小组对“影响石灰石与盐酸反应速率的因素——盐酸的浓度和石灰石的颗粒大小等”进行了如下实验探究,请你参与。
【进行实验】
室温下,选用20 mL不同溶质质量分数的盐酸(4%和6%)分别与1 g颗粒状或块状的石灰石进行实验(固定夹持仪器略去)。
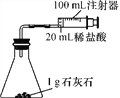
(1)石灰石与盐酸反应的化学方程式为____________________________________________________。
(2)按上图装置进行实验,在装药品前应检查该装置的气密性。开始实验时,应将20 mL稀盐酸________(填“快速”或“缓慢”)推入锥形瓶中,以保证盐酸能全部推入锥形瓶中。
【处理数据】
(3)实验小组进行实验后,获得的相关实验数据如下表所示:
实验
编号
盐酸溶质质
量分数(均取
20 mL)
石灰石固
体形状
(均取1 g)
二氧化碳的
体积(mL)(均
收集前30 s
的气体)
a
4%
颗粒
64.0
b
4%
块状
40.4
c
6%
颗粒
98.2
d
6%
块状
65.3
①要比较不同溶质质量分数的盐酸对反应速率的影响,可选择的实验编号是________(写一组),由此可得到的结论是____________________________。
②从上述实验中得出石灰石的颗粒大小对反应速率影响的结论是____________________。
【拓展延伸】
(4)下表是实验时记录生成的二氧化碳气体体积和对应的时间的一组实验数据(每间隔4 s读数一次):
时间/s
4
8
12
16
20
24
28
32
36
40
气体
体积/
mL
16.0
22.2
29.4
39.3
50.4
57.6
62.0
64.7
66.0
66.0
从上表数据可以分析得出,到20 s后反应速率逐渐变_______,其主要原因是_____________________。
相关试题

