【题目】在一烧杯中盛有2.4g金属镁,向其中加入一定质量的稀硫酸,充分反应后,向所得溶液中逐滴滴入未知溶质质量分数的氢氧化钠溶液,产生沉淀与滴入氢氧化钠溶液的质量关系曲线如图所示。
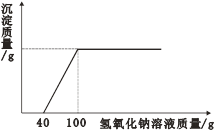
(1)完全反应后,产生沉淀的质量为________g;
(2)氢氧化钠溶液中溶质的质量分数是_________?(写出计算过程,结果精确到0.1%)
参考答案:
【答案】 5.8 13.3%
【解析】(1)完全反应后,产生沉淀的质量为∶Mg→Mg﹙OH﹚2,24→58,![]() =
=![]() ,x=5.8g。
,x=5.8g。
(2)解∶设氢氧化钠溶液中溶质的质量分数是x
2NaOH+MgSO4=Mg﹙OH﹚2↓+Na2SO4
80 58
60g×x 5.8g
![]() =
=![]() ,x=13.3%。
,x=13.3%。
点睛∶(1)完全反应后,产生沉淀的质量为5.8g。(2)氢氧化钠溶液中溶质的质量分数是13.3%。
点睛∶硫酸先与金属镁反应生成硫酸镁和氢气,然后硫酸镁再与氢氧化钠反应生成氢氧化镁白色沉淀和硫酸钠。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)电解水实验中,正极产生的气体是__________(填化学式),正极与负极产生气体的体积比约为_________。
(2)如下图是将树木纤维素转变为超级储能装置反应的微观示意图。请回答下列问题:

①反应前后,原子的_________、数目和质量都不变;
②该反应的化学方程式为_______________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的常见装置。
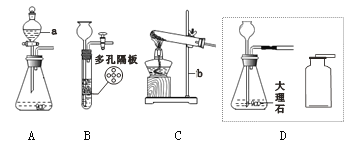
(1)写出所指仪器名称:a_________________,b_________________;
(2)实验室制取CO2的化学方程式是_________,发生装置选用B比选用A的突出优点是________。用装置D制取并收集CO2,请在虚框内补全导管_________。
(3)实验室用氯化铵(固体)和熟石灰(固体)混合加热制氨气,发生装置为________(填编号),发生反应的化学方程式为________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A、B、C、D、E是初中化学中常见的不同类别的物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“一”表示两端的物质能发生化学反应)。A是目前世界上使用最多的金属,C是工业制取二氧化碳的副产品,E是配制波尔多液的主要成分之一,其溶液为蓝色,F是由三种元素组成的化合物。请回答下列问题:
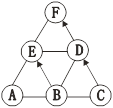
(1)写出E的化学式_________________;
(2)C在生活中的用途是_________________;
(3)写出D转化为F的化学方程式_____________________;
(4)B在物质分类上属于_______;上述反应中没有包含的基本反应类型是___________;
(5)A与B能发生反应的原因是____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在实验桌上有如下几种气体发生装置和收集装置.请你参与实验并回答问题:
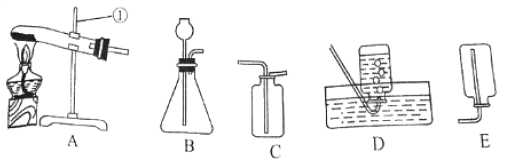
(1)写出标号①的仪器名称:____________________;
(2)实验室制取二氧化碳气体的发生装置为:____________________(填字母)
(3)用C装置收集二氧化碳,其验满的方法是:______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D、E、F六种物质均由非金属元素组成。其中D、F是组成元素相同的气体。它们存在如图所示的转化关系,“→”表示可以向箭头所指方向一步转化,“—”表示两种物质之间可以发生反应(反应条件与其他物质均已略去)。请回答下列问题:
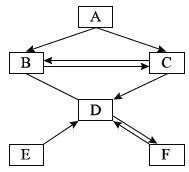
(1)写出F的化学式:____________________;
(2)写出B→C的化学方程式:____________________;
-
科目: 来源: 题型:
查看答案和解析>>【题目】在小英家的仓库里,堆放着一袋袋化肥一一碳酸氢铵( NH4HCO3).过了一个夏天,小英发现这种化肥所持有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了,检查发现变少的化肥包装袋没有密封,化肥也没有撒落在地上,更没有人进过仓库开袋使用。
为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味.粉末为什么会消失呢?
(1)(提出问题)碳酸氢铵粉末消失的原因是什么?
(2)(猜想)①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和一些氧化物。
(3)(查阅资料)①碳酸氢铵属于氨肥,不具有升华的性质,说明上述猜想__________ (填序号)不成立;②氨气(化学式NH3)具有特殊的刺激性气味,极易溶于水,其水溶液是碱性,但干燥的氨气不能使干燥的红色石蕊试剂变蓝;③NO2为红棕色气体。NO为无色气体,在空气中易发生反应:2NO+O2=2NO2
(4)(实验操作,现象与结论)

实验操作
实验现象
实验结论
①取适量碳酸氢铵于试管中加热,如图一所示,将干燥的红色石蕊试纸接近导管口
产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体
分解产物中有______,没有__________
②按如图二所示装置继续实验,直到反应完全
澄清石灰水变浑浊
分解产物中有__________
(5)(应用)①利用氨气的化学性质,请写出实验室检验氨气的方法(写出实验操作、现象、结论):________________________________________;
②如果你家里有碳酸氢铵化肥,你应该如何保存? ______________________________。
相关试题

