【题目】镁铜合金常用作飞机天线等导电材料,现取某镁铜合金3g放入烧杯中,加入50g稀硫酸恰好完全反应,反应后测得烧杯中剩余物的质量为52.8g。请计算:
(1)生成H2的质量为____________。
(2)该稀硫酸中溶质的质量分数为____________。
参考答案:
【答案】 0.2g 19.6%
【解析】本题考查的是根据化学方程式的计算,解答本题的关键是烧杯中的物质减少质量等于生成的氢气质量。
(1)根据题意可知,生成H2的质量=50g+3g-52.8g=0.2g;
(2)镁铜合金放入稀硫酸中,只有镁反应。设:生成0.2g氢气需要硫酸的质量为x;
Mg+H2SO4═MgSO4+H2↑
98 2
x 0.2g
![]() x=9.8g;
x=9.8g;
稀硫酸中溶质的质量分数=![]() ×100%=19.6%。
×100%=19.6%。
答:(1)生成氢气的质量为0.2g;
(2)该稀硫酸中溶质的质量分数为19.6%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组的同学探究木炭还原氧化铜的实验,实验装置如下图。实验时,a中的固体由黑色变红色,b中的试管内产生气泡和白色沉淀。
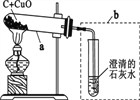
【查阅资料】氧化亚铜(Cu2O)是红色固体,能与稀硫酸发生如下反应:Cu2O+H2SO4= Cu+CuSO4+H2O。
【提出问题】已知实验后a中的红色固体含有单质铜,是否还含有氧化亚铜(Cu2O)呢?
【实验验证】取a中的红色固体少量于试管中,加入_______溶液,试管中出现__________,证明固体中确实含有Cu2O。
【提出问题】木炭还原氧化铜产生的气体是什么?
【提出猜想】猜想一:CO2 猜想二:CO 猜想三:____________
【提出质疑】甲同学认为猜想二不正确,他的理由是________________ 。
【验证猜想】乙同学将木炭还原氧化铜产生的气体通入灼热的氧化铜粉末中,黑色固体变红,证明猜想______是正确的,该反应的化学方程式为_______________________。
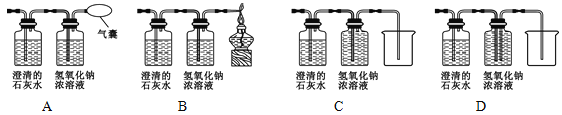
【交流反思】兴趣小组认为如图装置不够完善,为了防止尾气对空气的污染,应该把如图装置中的b部分装置换成下列___________装置(填字母序号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在实验室加热32.5g二氧化锰和氯酸钾的固体混合物制取氧气时,剩余固体物质的质量变化如下图所示。请计算:
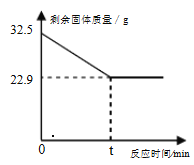
(1)完全反应时,生成氧气的质量为________克。
(2)完全反应后,剩余固体物质是_________(填化学式)。
(3)完全反应后,把剩余固体倒入100g蒸馏水中,充分溶解,求所得溶液中溶质的质量分数为_____________(最后结果保留0.1%)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下图所示实验回答问题。

(1)实验一铜片上的白磷燃烧红磷不燃烧,说明燃烧的条件之一是__________________。
(2)实验三当蒸发皿中________________________时,停止加热。
(3)实验四集气瓶中水的作用是__________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线,下列叙述错误的是
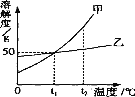
A.t1℃时,甲、乙两种物质的溶解度都是50g
B.t2℃时,在两种饱和溶液中,溶质的质量甲一定大于乙
C.t2℃时,将甲的饱和溶液降温至t1℃,其溶质的质量分数减小
D.t1℃时,将30g甲放到50g水中,所得溶液的溶质质量分数为37.5%
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列装置操作图不能用于检查气密性的是 ( )
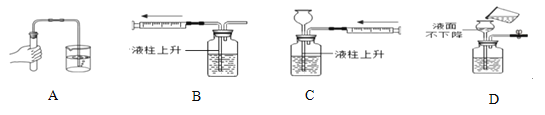
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用超临界水技术处理废弃电路板,能得到由CuO和Cu2O组成的固体残渣,将残渣进行进一步处理可得硫酸铜晶体(CuSO45 H2O)等物质。处理流程如下图所示。下列说法正确的是 ( )
(已知:Cu2O + H2SO4 CuSO4 + Cu + H2O)
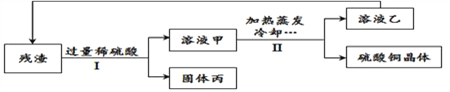
A. I中含过滤操作,II中不含过滤操作
B. 溶液甲和溶液乙一定为硫酸铜的饱和溶液
C. 残渣的处理流程中,H2SO4和CuSO4实现了循环利用
D. 经操作I后,残渣由22.4g减少为6.4g,则经过一次循环后能得到硫酸铜晶体50.0g
相关试题

