【题目】在下图所示的转化关系中,![]() 等都是初中化学学过的物质,其中
等都是初中化学学过的物质,其中![]() 是单质,
是单质,![]() 是化合物。
是化合物。
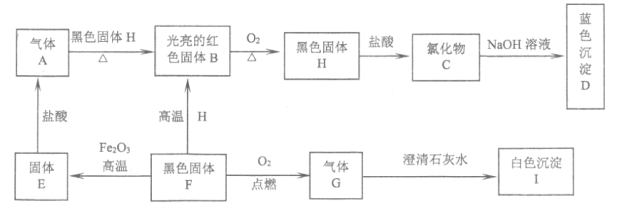
(1)写出![]() 的化学式:A_____F_____。
的化学式:A_____F_____。
(2)根据上述转化关系,写出有关反应的化学方程式。
![]() :_____;
:_____;
![]() :_____。
:_____。
参考答案:
【答案】H2 C CO2+Ca(OH)2= CaCO3↓+H2O 2CuO+C![]() 2Cu+CO2↑
2Cu+CO2↑
【解析】
根据蓝色沉淀D应是氢氧化铜,可知光亮红色的B单质是铜,和氧气加热得到的黑色固体H是氧化铜,氧化铜和盐酸反应生成的氯化物C就是氯化铜,氯化铜和氢氧化钠反应生成蓝色氢氧化铜沉淀D;再根据气体A能和黑色固体氧化铜反应生成铜,可知气体单质A具有还原性,是氢气,再根据黑色固体F和氧化铁高温反应生成固体E,固体E和盐酸反应生成气体A,进一步确定A为氢气,固体E为铁,铁和稀盐酸反应生成氯化亚铁和氢气;黑色固体F是碳,碳在高温条件下还原氧化铁生成铁,碳在高温条件下能还原H氧化铜生成铜;则气体G是二氧化碳,碳和氧气在点燃的条件下生成二氧化碳;二氧化碳和澄清石灰水反应生成白色沉淀碳酸钙I,将各物质带入框图检验合理,推断成立。
(1)由上分析可知A为氢气,化学式为H2;F为碳,化学式C;
(2)G是二氧化碳气体,I是碳酸钙,由图示可知二氧化碳和澄清石灰水反应生成碳酸钙沉淀和水,反应的化学方程式为CO2+Ca(OH)2= CaCO3↓+H2O;
F是碳,H是氧化铜,B是铜,碳还原氧化铜生成铜和水,反应的化学方程式为2CuO+C![]() 2Cu+CO2 ↑。
2Cu+CO2 ↑。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组的同学在实验室练习配制一定溶质质量分数的氯化钠溶液。
(1)配制50g质量分数为6%的氯化钠溶液。步骤如下:
①计算:需要氯化钠的质量为_____g。
②称量:调节托盘天平平衡,_____(填字母序号),直至天平平衡。
A 先在左盘纸片上加氯化钠,后在右盘纸片上加砝码
B 先在右盘纸片上加砝码,后在左盘纸片上加氯化钠
③溶解:用量筒取所需的水,倒入盛有氯化钠的烧杯中,用玻璃棒搅拌,使氯化钠溶解。
④把配好的溶液装入_____(填“广口瓶”或“细口瓶”),盖好瓶塞并贴上标签。
(2)用已配好的质量分数为6%的氯化钠溶液(密度约为1.04g/cm3),配制100g质量分数为3%的氯化钠溶液,需要量取6%的氯化钠溶液_____
 (计算结果保留到0.1)。
(计算结果保留到0.1)。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室常用气体制备装置,据图回答问题
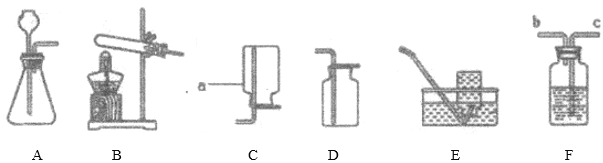
(1)写出图中仪器a的名称_____。
(2)实验室用加热高锰酸钾制取并收集氧气,发生反应化学反应方程式为_____。
图1中应选择的发生装置为_____(填字母序号)。用A装置_____(填“能”或“不能”)制备氧气?
(3)实验室制取并收集二氧化碳,发生反应化学反应方程式为_____。
图1应选用的制取并收集装置是_____(填字母序号)。将二氧化碳通入紫色石蕊溶液中,紫色石蕊溶液变_____色。
(4)图2F装置有多种用途,如可用于气体干燥、除杂等。干燥二氧化碳时,气体应该从_____处进入(填“b”或“c”),除去一氧化碳中的二氧化碳时,瓶中液体可以是_____(填数字序号)。
①浓硫酸 ②烧碱溶液 ③稀硫酸 ④饱和碳酸氢钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献,工业上用侯氏制碱法制得的纯碱中含有一定量的氯化钠杂质,现称取只含氯化钠杂质的纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g。
试求:(1)该纯碱样品的纯度(计算结果精确到0.1%)
(2)所得溶液中溶质的质量分数。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水、溶液与人们的生产生活密切相关请回答:
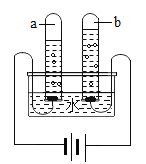
(1)如图所示电解水的实验中,试管a、b中产生气体的体积比约为_____,该实验证明水是由_____组成的。
(2)下列净化水的单一操作中,相对净化程度较高的是_____(填字母)。
A 静置沉淀 B 吸附沉淀 C 过滤 D 蒸馏
(3)测定某地下水的酸碱度,最简单的方法是使用_____。
(4)下图是三种固体物质的溶解度曲线。根据溶解度曲线回答问题:
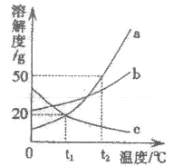
①物质c的溶解度随温度的升高而_____;
②物质a的溶解度大于物质c的溶解度的温度范围_____;
③
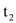 ℃时,用50g水配制物质a的饱和溶液,至少需要a物质_____g;
℃时,用50g水配制物质a的饱和溶液,至少需要a物质_____g;④将
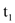 ℃时
℃时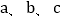 三种物质的饱和溶液升温至
三种物质的饱和溶液升温至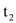 ℃(溶剂量不变),溶液中溶质质量分数不变的是_____。
℃(溶剂量不变),溶液中溶质质量分数不变的是_____。 -
科目: 来源: 题型:
查看答案和解析>>【题目】实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。
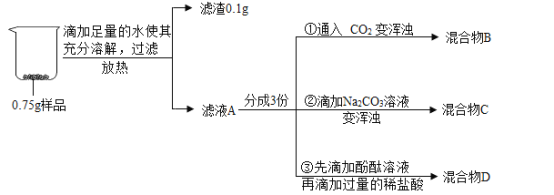
回答下列问题:
(1)样品加水放热的原因是_____(化学方程式表示)。
(2)②中反应的化学方程式是_____。
(3)③中的实验现象是_____。
(4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1g滤渣。向滤液E中滴加
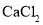 溶液,有白色沉淀生成,依据实验现象及数据判断,原样品的成分是_____。
溶液,有白色沉淀生成,依据实验现象及数据判断,原样品的成分是_____。 -
科目: 来源: 题型:
查看答案和解析>>【题目】金属及金属材料在日常生活中应用广泛。
(1)铝块能制成铝箔是利用了铝的_____性(填“导电”或“延展”)。
(2)X,Y,Z三种常见金属及其盐溶液存在以下反应,则三种金属的活动性顺序正确是_____(填字母)。
①
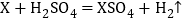 ②
②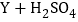 不发生反应③
不发生反应③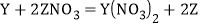 .
.A
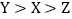 B
B 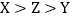 C
C 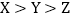 D
D 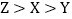
(3)金属钛(Ti)不仅能在空气中燃烧,也能在二氧化碳或氮气中燃烧.在稀有气体和高温条件下,用四氯化钛和镁发生置换反应可制备金属钛。请写出四氯化钛制备金属钛的化学方程式是_____。
(4)“辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料,它很容易与空气中的_____等发生反应而锈蚀。用稀盐酸除铁锈的化学方程式是_____。
(5)某钢铁厂每天需消耗4900t含
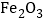 76%的赤铁矿石,该厂理论上可日产含
76%的赤铁矿石,该厂理论上可日产含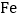 98%的生铁的质量是_____t。
98%的生铁的质量是_____t。(6)将一定量的锌粉放入稀盐酸、氯化亚铁、氯化铜的混合溶液中,充分反应后过滤,再向滤渣中加盐酸有气泡产生,则滤渣中一定含有的固体是_____(写化学式);滤液中一定不含的物质是_____(写化学式)。
相关试题

