【题目】某研究性学习小组在验证“碱使酚酞试液变红”的实验时,发现一个意外现象:将酚酞试液滴入某NaOH溶液中,溶液变成了红色,可是过一会儿红色却消失了。
【提出问题】是什么原因导致滴有酚酞的NaOH溶液由红色褪为无色?
【猜想与假设】他们分别对这种意外现象作如下猜想:
甲同学:可能是酚酞与O2发生了反应;
乙同学:可能是NaOH溶液与空气中的CO2发生了反应;
丙同学:可能与NaOH溶液浓度大小有关;
你认为可能还与_________________________________有关(写一条即可)。
【设计实验】三位同学分别设计实验验证自己的猜想:
(1)甲同学设计了如下实验,请你填写下表。
实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
1.将NaOH溶液加热煮沸 | 溶液变红,过一会儿红色消失 | 甲同学猜想_______(填“正确”或不正确”) | |
2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方 |
(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。请写出CO2与NaOH溶液反应的化学方程式:________________________。甲同学认为乙同学的实验不够严谨,理由是__________________________________________________。

[注意:若答对第(3)小题奖励4分,化学试卷总分不超过60分。]
(3)丙同学使用了色度传感器测溶液的颜色。他在a、b、c三个比色皿中分别加入等量5%、10%、20%的NaOH1溶液,然后各滴加2滴酚酞试液。溶液颜色的变化曲线如图[说明:溶液无色时色度值(透过率)为100%]。请你观察下图回答问题。
①写出两条规律性结论:_____________________;____________________。

②推测5%的NaOH溶液滴加2滴酚酞试液后褪为无色的时间约为( )
A.小于30s
B.30-90s
C.90-140s
D.140-180s
E.180-280s
F.大于280s
参考答案:
【答案】仪器不干净,含有酸性物质(合理均可)
(1)
实验步骤 | 设计这一步骤的目的 | 实验现象 | 实验结论 |
1.将NaOH溶液加热煮沸 | 除去溶液中的氧气 | 溶液变红,过一会儿红色消失 | 甲同学猜想不正确_ |
2.向冷却后的…… | 隔绝氧气 |
(2)2NaOH+CO2 =Na2CO3+H2O 若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去
(3)①氢氧化钠溶液的浓度越大,酚酞试液变红后褪色越快;氢氧化钠溶液的浓度越小,色度值越大。②F
【解析】
试题分析:【猜想与假设】他们分别对这种意外现象作如下猜想我认为可能还与仪器不干净,含有酸性物质有关;【设计实验】三位同学分别设计实验验证自己的猜想:(1)甲同学设计了如下实验1.将NaOH溶液加热煮沸,其目的是除去溶液中的氧气,2.向冷却后的溶液中滴人酚酞,并滴一些植物油在其上方目的是隔绝空气(或氧气)实验现象为溶液变红,过一会红色消失,实验结论是甲同学的猜想不正确;(2)乙同学设计如图装置进行实验,一段时间后,试管中溶液的红色褪去,于是认定自己的猜想正确。CO2与NaOH溶液反应的化学方程式:2NaOH+CO2 =Na2CO3+H2O;。甲同学认为乙同学的实验不够严谨,理由是若制取的二氧化碳气体中混有氯化氢气体,试管中溶液的红色也能褪去;(3)丙同学使用了色度传感器测溶液的颜色;观察右图,可知结论①:氢氧化钠溶液的浓度越大,酚酞试液变红后褪色越快;氢氧化钠溶液的浓度越小,色度值越大。②推测5%的NaOH溶液滴加2滴酚酞试液后褪为无色的时间约为大于280秒,因为其色度变化由85%到95%时需要140秒多点,故到完全消失需要280秒以上。选择F
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两同学在学完酸的化学性质后,做了如下实验:
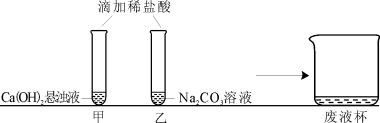
【观察与讨论1】甲同学在做实验时观察到的明显现象是 ① 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。所以甲同学认为,乙同学实验时还应 ② ,才能观察到有气泡产生。
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。经过讨论确定,甲同学的试管中废液含有的溶质一定有 ③ ,乙同学的试管中废液含有的溶质一定有 ④ (均写化学式)。
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】猜想1:废液中含有 (写化学式)两种溶质。
猜想2:废液中含有 (写化学式)三种溶质。
猜想3:废液中含有NaHCO3、CaCl2、 NaCl三种溶质。
【活动与探究】甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生。
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色。
【结论与反思】(1)猜想 (填“1”或“2” 或“3”)正确。
(2)要得到相同的结论,还可采用很多种方法。如加入氧化铁粉末,可观察到溶液呈 色,该反应的化学方程式为 。
【表达与交流】甲、乙同学确认了最终废液中溶质的成分,若直接排放,可能造成的危害是 ,你认为处理该废液的方法是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验小组用下图装置研究CO2的性质。
提示:①忽略块状大理石中杂质对本实验的影响
②碱性碳酸钠溶液与中性氯化钙溶液能发生复分解反应
(1)如下图所示,装入药品,打开K,玻璃管b中反应的化学方程式为__________,导管口处的现象是______________。
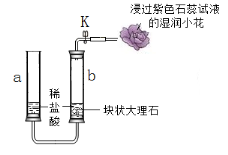
(2)关闭K,一段时间后反应停止。反应能够停止的原因是______________。
(3)反应停止后,向a中滴入酚酞溶液,并加入一定量碳酸钠固体,充分反应后a中溶液呈红色。打开K,待a、b中液面相平后立即关闭K,轻轻振荡b管。一段时间后观察到的现象是____________,最终b中红色褪去,此时b中溶液的溶质可能为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组用如图所示装置研究以下两个问题。
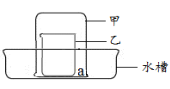
【实验1】可燃物燃烧的条件
步骤1:水槽中放有一定量热水,水面下a处放一小块白磷,此时观察到白磷不燃烧。
步骤2:在乙中放入二氧化锰和过氧化氢溶液,立即将甲倒扣在乙上。
此时观察到甲中水面下降,白磷露出水面, 。
此实验运用对比的方法研究了可燃物燃烧的一个条件是 。
【实验2】浓盐酸的性质
步骤1:a处放一湿润的紫色石蕊试纸,乙中放入浓盐酸,立即将甲倒扣在乙上。此时观察到试纸变为红色。说明浓盐酸具有的性质为 。
步骤2:将试纸取出,立即向水槽中加入滴有酚酞的氢氧化钠溶液,此时观察到红色溶液逐渐变为无色。出现此现象的原因是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小强在一次查阅资料时得知:二氧化碳与氢氧化钠反应,若二氧化碳过量,生成的碳酸钠会继续与二氧化碳反应生成碳酸氢钠,反应原理为:Na2CO3+CO2+H2O=2NaHCO3.出于好奇,他和同学一起向一定量的氢氧化钠溶液中通入一定量的二氧化碳,充分反应后,低温蒸发结晶,得到了白色固体.
【提出问题】白色固体是什么?
【作出猜想】
猜想Ⅰ:只有Na2CO3;
猜想Ⅱ:可能是Na2CO3和NaOH的混合物;
猜想Ⅲ: _________
【査阅资料】
(1)碳酸氢钠不稳定受热易分解2NaHCO3
 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O(2)Na2CO3与NaOH的热稳定性较好
(3)CaCl2和NaCl的水溶液呈中性
【设计实验】
取一定量的白色固体,加热,若固体质量不变,猜想 _________ 错误;若固体质量减少,则二氧化碳与氢氧化钠反应后, _________ 过量.
【交流讨论】
小方认为,要想知道白色固体中是否有氢氧化钠,可将白色固体配成溶液后,直接用pH试纸测试即可作出判断,你认为是否可行? _________ ;理由是 _________ .
【继续探究】白色固体中是否有氢氧化钠?
实验操作
实验现象
目的/结论
①取白色固体适量配制成溶液.往所得溶液中滴加过量的 _________ ,充分反应后,过滤.
有白色沉淀生成
除去白色固体中的
_________
②取滤液,往滤液中滴入几滴 _________
_________
白色固体中没有氢氧化钠
【交流与反思】
由于氢氧化钠能与二氧化碳反应,所以实验室保存氢氧化钠一定要注意 _________ .
-
科目: 来源: 题型:
查看答案和解析>>【题目】煤的综合利用是将煤隔绝空气加强热,使煤分解成许多有用的物质,煤气是其中一种。煤气的主要成分是什么呢?某兴趣小组为此展开了探究。
【查阅资料】(1)煤气中可能含有 CO、CO2、H2、CH4 中的一种或几种。
(2)常温下,氯化钯(PdCl2)溶液吸收 CO 时发生的化学反应方程式为:
CO +PdCl2+H2O
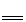 CO2+Pd↓(灰色) +2HCl
CO2+Pd↓(灰色) +2HCl【实验方案】兴趣小组的同学设计如下装置探究煤气中的成分。
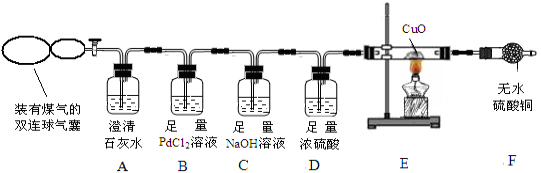
【交流讨论】请回答实验中的有关问题:
(1)实验开始后,A 中无明显现象,说明煤气中不存在____________________;
(2)若煤气中有 CO 存在,则 B中产生的现象是 ;
(3)写出 C 中发生反应的化学方程式__________________________(写一个即可);
D 中浓硫酸的作用是_________________________。
(4)若 F 中无水CuSO4变蓝色,则E中一定发生的化学方程式为 ;
(5)点燃F装置导出的气体,有火焰产生。江枫认为煤气中含 CH4,理由是CH4可以燃烧,CH4燃烧的化学方程式是___________________,老师则认为不能确认煤气中含有 CH4,理由是______________________。为了确定煤气中是否有CH4,老师接着采取的操作方法是 ;观察到的现象是___________________________________。由此验证煤气中一定含有CH4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学实验中能达到预期实验结果的是
A. 借助托盘天平和其他手段测定铜锌合金中锌的质量分数为36.25%
B. 用pH试纸测定某未知溶液的pH为5.5
C. 20℃时,配制2%的氢氧化钙溶液
D. 将100g 10%的稀盐酸加热蒸发掉50g水,使得稀盐酸溶质质量分数变成20%
相关试题

