【题目】实验室有一瓶长期放置的氢氧化钠固体,某兴趣小组同学欲对该固体变质情况进行探究。
Ⅰ.固体的成分分析
【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?
【查阅资料】①氢氧化钠在空气中容易变质但不会转化为NaHCO3;
②CaCl2溶液的pH=7。
③碱石灰是CaO和NaOH的混合物
【提出猜想】猜想Ⅰ:固体未变质,只有NaOH
猜想Ⅱ:固体全部变质,只有Na2CO3
猜想Ⅲ:固体部分变质,是NaOH 和Na2CO3 的混合物
【原因分析】氢氧化钠在空气中变质的原因是_______________(用化学方程式表示)。
【进行实验】小聪同学取少量样品于烧杯中,用足量水溶解,再向溶液中滴入几滴酚酞试液,溶液变红,由此他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是________________,为了进一步得出结论,组内其他三位同学分别取小聪实验后的溶液于试管中,进行如下表所示实验。
同学 | 小钱 | 小徐 | 小陆 |
实验操作 | 加入适量氢氧化钙溶液 | 加入过量氯化钙溶液 | 逐滴加入稀盐酸至过量 |
【实验结论】小钱、小徐的实验中都观察到有白色沉淀生成且溶液仍是红色,于是他们都得出猜想Ⅲ正确。
【反思评价】(一)老师指出,仅凭小钱的实验操作和现象无法确定猜想Ⅲ正确,理由是__________________。
(二)根据小徐的结论推测小陆实验现象是_________________________________。
Ⅱ 固体中各成分含量
【提出问题】如何测定变质的氢氧化钠固体中碳酸钠的质量分数?
【进行实验】化学小组同学设计了如下实验装置。
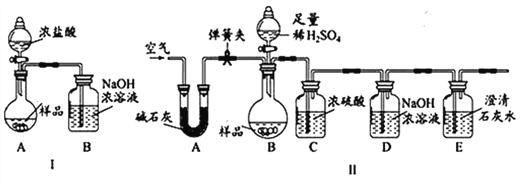
(一)小陆同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 _______________________;
(二)小钱同学在大家讨论的基础上,设计了装置II。请分析:装置II中A的作用_____________;若无装置C,对测定结果造成的影响是_____________(填“偏大”、“偏小”或“无影响”);E装置的作用是_______________________________。
【实验结论】称取10g样品于圆底烧瓶中,实验结束后,测得装置D增重2.2g,请你计算出样品中Na2CO3质量分数为____________。(写出计算过程)
【反思评价】(一)实验室中的氢氧化钠应密封保存,除了因为空气中有二氧化碳,还因为___________。
(二)若将上述5g氢氧化钠固体全部溶解在45g水中,得到的溶液中氢氧化钠质量分数______10%(填“大于”、“小于”或“等于”)。
参考答案:
【答案】 2NaOH+CO2═Na2CO3+H2O 碳酸钠显碱性 有新的氢氧化钠生成 先无明显现象,后有气体生成,无色酚酞褪色 浓盐酸挥发性 除空气中二氧化碳 偏大 防止空气中二氧化碳进入或证明二氧化碳除尽 5.3 吸水 小于
【解析】Ⅰ固体的成分分析【原因分析】氢氧化钠在空气中变质的原因是氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;【进行实验】他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是碳酸钠溶液、氢氧化钠溶液都显碱性,都能使酚酞试液变红色,因此无论氢氧化钠是否变质,溶液都能使酚酞试液变红色;【反思评价】(一)老师指出,仅凭小钱的实验操作和现象无法确定猜想Ⅲ正确,理由是:碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,产生的氢氧化钠干扰对样品中氢氧化钠的检验;(二)小徐的实验中都观察到有白色沉淀生成且溶液仍是红色,说明氢氧化钠部分变质,即样品中含有氢氧化钠和碳酸钠,加入过量稀盐酸时,稀盐酸先和氢氧化钠反应,后和碳酸钠反应,因此小陆实验现象是开始无明显现象,一会儿后产生气泡,溶液由红色逐渐变成无色;Ⅱ、固体中各成分含量
【进行实验】化学小组同学设计了如下实验装置。小组内同学通过讨论认为不可以,其理由可能是:浓盐酸易挥发,挥发出的氯化氢气体也被装置B吸收了;装置II中A的作用是吸收空气中的二氧化碳和水蒸气;若无装置C,水蒸气会进入D装置中,导致测定的二氧化碳质量偏大,进一步导致测定结果偏大;E装置的作用是防止空气中二氧化碳进入或证明二氧化碳除尽; 【实验结论】设10g样品中碳酸钠的质量为x,
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,
106 44
x 2.2g
![]() ,
,
x=5.3g
样品中碳酸钠质量分数为: ![]() ,【反思评价】①联想到空气中有CO2,为了防止氢氧化钠和二氧化碳反应,实验室中的氢氧化钠应密封保存;②若将上述5g氢氧化钠固体全部溶解在45g水中,由于固体中含有碳酸钠,因此氢氧化钠的质量小于5g,得到的溶液中氢氧化钠质量分数小于10%。
,【反思评价】①联想到空气中有CO2,为了防止氢氧化钠和二氧化碳反应,实验室中的氢氧化钠应密封保存;②若将上述5g氢氧化钠固体全部溶解在45g水中,由于固体中含有碳酸钠,因此氢氧化钠的质量小于5g,得到的溶液中氢氧化钠质量分数小于10%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下面是实验室常用的仪器
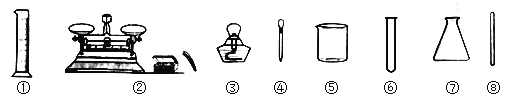
请回答下列的问题:
(1)可直接加热的有__________ (填序号)。
(2)滴加少量液体用__________ (填序号)。
(3)用仪器①能否量取8.68ml溶液__________ (填“能”或“否”)。
(4)过滤时玻璃仪器除了用到⑧外,还需用到漏斗及以上的__________ (填仪器名称)。
(5)活性炭的作用是____________。
(6)过滤操作中玻璃棒的作用是__________。
(7)小东到学校实验室用漏斗过滤后,滤液仍然浑浊,请你帮其分析原因。________________(写出一个原因)
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取气体所需装置如下图所示.
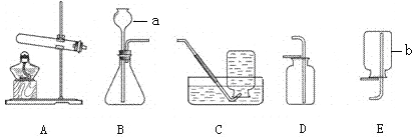
(1)实验仪器a、b的名称是a______、b_______.
(2)用大理石和稀盐酸制取二氧化碳时,所选用的发生装置是_____(填序号),其反应的化学方程式是______.
﹙3﹚用高锰酸钾制取氧气,其反应的化学方程式是______。试管口应放_______________。 实验结束,停止加热前要先将导管移出水面,目的是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在实验室里加热30g氯酸钾(KClO3)和二氧化锰的混合物制取氧气,完全反应后剩余固体质量为20.4g。请计算:(1)生成氧气的质量为________。 (2)原混合物中氯酸钾和二氧化锰的质量为________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】我们生活在一个丰富多彩的物质世界中,人类的生产、生活和化学密不可分。
(1)用适当的化学符号填空。
①汽水中含有的一种酸___________________ ②人体中含量最多的金属元素___________
③医院用来配置消毒液的盐_______________ ④碱溶液中都含有的一种离子___________
(2)以下是日常生活中常用各种清洗剂。

①使用洗涤灵牌洗涤剂清洗餐具上的油污,这是因为它具有_____________功能。
②清除以下物质,可使用炉具清洁剂的是____________(填字母序号)。
A.铁锈 B.油污 C.水垢(主要成分CaCO3和Mg(OH)2)
③“污渍爆炸盐”溶于水后会生成Na2CO3和H2O2。将爆炸盐溶于水后,加入少量二氧化锰,会产生少量气泡,该气体是____________________。
④将洁厕灵加入滴有酚酞的炉具清洁剂中,若反应后溶液呈红色,则反应后溶液中的溶质是(酚酞除外)______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水与人类的生活息息相关。
(一)、天然水净化为自来水的主要流程如下:
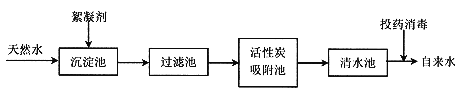
(1)下列说法不正确的是(填字母)________。
A.过滤池可以除去难溶性杂质 B.活性炭吸附池可以除去水中的色素和臭味 C.清水池中一定是软水
(2)明矾(主要成分KAl(SO4)m)能作絮凝剂,是因为明矾溶于水后生成具有吸附作用的胶状物氢氧化铝。m=______
(3)生活中,人们常用__________检验水样品是硬水还是软水。硬水危害人们健康,生活中软化硬水最常用、最简单的方法是____________。
(4)水是生命之源,我国水资源总量虽位居世界第六位,但人均水量很少。请你写出一条节约用水的方法:_____________________。
(二)、下图是实验室电解水原理的装置图
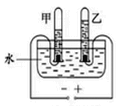
(1)保持水的化学性质的最小微粒是________,图中试管乙中的气体是______(均填名称)。
(2)电解水的化学方程式是_________________________。
(3)实验室用“电解水”或“氢气在氧气中燃烧”的实验探究水的组成元素,理论依据是______。
-
科目: 来源: 题型:
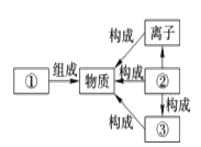
查看答案和解析>>【题目】在宏观、微观和符号之间建立联系是化学科学习的特点。
(1)某同学绘制的知识间联系图如下图所示。其中②是_______(填“分子”、“原子”或“元素”)。
(2)下图所示为某些元素和原子结构的部分信息。
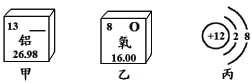
①乙图所示元素的原子的核电荷数是_______。
②丙图所示的粒子属于_______(填“原子”、“阳离子”或“阴离子”。
③其中属于非金属元素的是_________(填甲、乙或丙)。
(3)若用
 表示氧原子,用
表示氧原子,用 表示氢原子.则
表示氢原子.则 表示__,
表示__, 表示__,
表示__, 表示__(填化学符号)
表示__(填化学符号)(4)如下图所示“
 ”和“
”和“ ”表示两种不同的原子.
”表示两种不同的原子.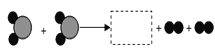
①该反应中反应物_______(填“可能”或“不可能”)是氧化物。
②图中虚线方框内对应的微观图示是_______(选A、B、C、D)。
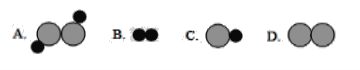
③该化学反应的基本类型属于________________________。
相关试题

