【题目】在NaOH和Na2CO3的混合物9.3g中加入一定量的10.0%的稀盐酸,恰好完全反应, 将生成的气体全部通入足量的澄清石灰水中,产生5.0g沉淀。下列说法正确的是( )
A. 题中的一定量是7.3g
B. 反应共产生11.7gNaCl
C. 如用10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的一定量相等
D. Na2CO3消耗的稀盐酸比NaOH消耗的稀盐酸多
参考答案:
【答案】B
【解析】解:设生成5.0g沉淀需要二氧化碳的质量为x则:
CO2+Ca(OH)2=CaCO3↓+H2O
44 100
x 5.0g
![]()
x=2.2g,
设生成2.2g二氧化碳时,需要碳酸钠的质量为a,需要氯化氢的质量为b,生成氯化钠的质量为c,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
a b c 2.2g
![]()
解得:a=5.3g,b=3.65g,c=5.85g
混合物中氢氧化钠的质量=9.3g-5.3g=4.0g,
与氢氧化钠反应的氯化氢的质量为d,生成氯化钠的质量为e
NaOH+HCl=NaCl+H2O
40 36.5 58.5
4.0g d e
![]()
d=3.65g,e=5.85g
A、加入的10.0%的稀盐酸的质量为(3.65g+3.65g) ![]() 10%=73g,故A错误;B、生成氯化钠的质量为5.85g+5.85g=11.7g,故B正确;C、由方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O,CaCO3+2HCl═CaCl2+CO2↑+H2O,可知2HCl~CO2~CaCO3~2HCl,10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的与碳酸钠反应所需的量相等,故C错误;D、根据计算可知Na2CO3消耗的稀盐酸与NaOH消耗的稀盐酸相等,故D错误。故选B。
10%=73g,故A错误;B、生成氯化钠的质量为5.85g+5.85g=11.7g,故B正确;C、由方程式:Na2CO3+2HCl═2NaCl+H2O+CO2↑,CO2+Ca(OH)2═CaCO3↓+H2O,CaCO3+2HCl═CaCl2+CO2↑+H2O,可知2HCl~CO2~CaCO3~2HCl,10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的与碳酸钠反应所需的量相等,故C错误;D、根据计算可知Na2CO3消耗的稀盐酸与NaOH消耗的稀盐酸相等,故D错误。故选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学用下图装置制取氧气(浓硫酸有吸水性且不与氧气反应),请回答:

(1)实验室制取气体的发生装置和收集装置类型的确定应根据________ (填序号)
A、药品的状态 B、生成气体的密度和在水中的溶解性
C、反应的条件 D、药品的价格
(2)检查装置②气密性的方法是________________;
(3)用高锰酸钾制取氧气的反应表达式是_______,所选用的发生和收集装置是_________(填序号)。
(4)用双氧水和二氧化锰制取氧气的反应表达式是___________________,发生和收集干燥氧气的装置及顺序应是______________(填序号);实验时若要控制液体滴下的速度,你的改进措施是____;检验氧气是否收满的方法是_________________。
(5)装置②试管口要略向下倾斜的原因是____________________ ;
(6)若用装置④收集的氧气不纯,其原因可能是:________________ 。
(7)你认为实验室选用上述仪器还可用来制取的气体有____________ (写一种)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】环境问题是人类可持续发展必须解决的一个重要问题,温室效应被列为21世纪人类面临的最大威胁之一,已引起人们的广泛关注。旨在限制发达国家温室气体排放量、抑制全球范围内气候持续变暖的《京都议定书》,已于2005年2月16日正式生效。
(1)二氧化碳是大气中的主要温室气体,我国二氧化碳的排放量位居世界第二,为减缓温室效应,我们可以采取的措施有(只填2种):________________;_____________。
(2)为减缓二氧化碳使全球变暖的趋势,有科学家提出大胆设想:将排放到空气中的二氧化碳压缩使其液化,然后将其压入到冰冷的深海中。但也有科学家担心海水中富含二氧化碳后酸度会增加,可能会杀死一些海洋生物,甚至会溶解掉部分海床,同时气候变化也可能改变海洋环流,把海底的二氧化碳又带回海面,另外把二氧化碳压入海底所消耗的能源可能会再增加二氧化碳的排放。已知温度越高、压强越小,气体在水中溶解得越少。
A、 二氧化碳气体转变为液体时将会__________能量(填“释放”或“消耗”);
B、二氧化碳使海水酸度增加的原理的反应表达式为_________ ;
C、二氧化碳在深海中比在通常状况下的水中的溶解得(填“多”或“少”)_______,原因是_____________。
(3)二氧化碳在化学家的眼里是可以利用的重要资源,只要有合适的条件,可以像发生光合作用那样将二氧化碳转变为所需要的产物。二氧化碳可以为化工合成提供足够的碳元素,既可以减少化工产业对煤和石油的消耗,又可以缓解大气中二氧化碳含量的增加。
A、二氧化碳和水通过光合作用转变为葡萄糖和氧气的反应表达式为:_______________。
B、我国科学家陈乾旺等最新研究成果表明,在一定条件下,二氧化碳和金属钠反应产生金刚石和碳酸钠,请从人类生存的角度分析,金刚石与水相比谁更宝贵______,理由是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲和乙可以制备化工原料丙,微观过程如下图。下列说法错误的是( )

A. 丁的化学式为O2
B. 丙中C、H的质量比为12:1
C. 该反应体现无机物可转化为有机物
D. 若改变反应条件,甲和乙反应可生成一种重要的糖类物质
-
科目: 来源: 题型:
查看答案和解析>>【题目】KCl和KNO3的溶解度表及溶解度曲线如下图所示,下列说法不正确的是 ( )
温度/℃
20
30
40
50
溶解度S/g
KCl
34.0
37.0
40.0
42.6
KNO3
31.6
45.8
63.9
85.5
A. 甲表示KCl溶解度曲线

B. 温度t1应在20℃~30℃之间
C. 40℃时,5gKCl加入10g水中,可得到33.3%的溶液
D. 50℃时,30g KNO3加入50g水,充分溶解,再降温到30℃,有晶体析出
-
科目: 来源: 题型:
查看答案和解析>>【题目】烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是( )
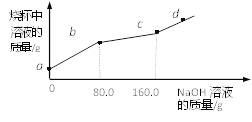
A. ab段反应产生蓝色沉淀
B. bc段溶液增加70.2g
C. c点对应的溶质质量分数为4.9%
D. d点溶液显碱性
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。流程简图如下(已知:母液中有一种铵态氮肥) ,下列有关说法不正确的是 ( )
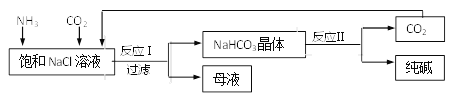
A. 反应中先通入氨气的目的是促进二氧化碳的吸收,提高产率
B. “母液”中一定只含有两种溶质
C. 反应II得到的CO2可以循环使用
D. 反应I的方程式为NaCl+NH3+CO2=NaHCO3↓+NH4Cl
相关试题

