【题目】如图表示几种物质之间的转化关系:
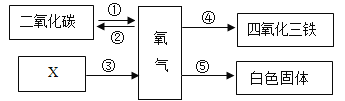
(1)反应①有利于维持空气中氧气含量的基本稳定,绿色植物实现转化①的过程发生了_____(填标号)
A.呼吸作用 B.光合作用 C.燃烧反应
(2)写出反应②中的另一种反应物_____.
(3)若反应③是分解反应,从物质的组成上分析,X中一定含有_____元素.
(4)反应④的化学方程式为_____.
(5)反应⑤燃烧时发出耀眼的白光,经常用做照明弹,其反应原理用化学方程式表示为_____.
参考答案:
【答案】 B 碳 氧 3Fe+2O2![]() Fe3O4 2Mg+O2
Fe3O4 2Mg+O2![]() 2MgO
2MgO
【解析】(1)绿色植物进行光合作用消耗二氧化碳,产生氧气,维持空气中氧气、二氧化碳的含量基本稳定。(2)碳在氧气中燃烧生成二氧化碳。(3)化学反应前后元素的种类不变。(4)铁丝在氧气中燃烧生成四氧化三铁。(5)镁燃烧时发出耀眼的白光,经常用做照明弹。
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活处处有化学.
Ⅰ.毛巾用久了会变硬变黄,原因之一是:用毛巾洗脸时,水中的钙、镁离子与肥皂作用产生沉淀物(沉淀物可溶于白醋)吸附于毛巾上.根据要求回答问题:
(1)证明水是硬水,可使用的试剂是_____,观察到的现象是_____.
(2)为避免毛巾变硬变黄,其中一种方法是降低水的硬度.下列方法中可以降低水硬度的是_____(填标号).
A.过滤 B.沉降 C.煮沸 D.吸附
(3)要使已用久的毛巾变软,日常生活中可采用的一条措施是_____.
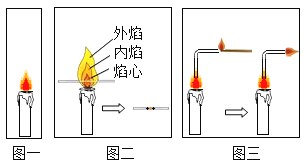
Ⅱ.化学兴趣小组的同学对蜡烛及其燃烧进行了如下探究.
(1)参考图一,取一支短蜡烛,用小刀切下一小块,放入水中,蜡烛一直浮在水面上.请据此写出常温下蜡烛的一点物理性质:_____.
(2)参考图二,怎样利用燃着的蜡烛和小木条证明蜡烛的外焰温度最高:_____.
(3)参考图三,将玻璃导管插入焰心,用燃烧的木条靠近导管另一端,发现导出的气体可以点燃,形成有趣的“母子火焰”现象.该实验成功的关键因素是导管不宜太长,否则在导管末端就看不到子火焰,从燃烧条件分析,此时缺少的条件是_____.由此可知:蜡烛燃烧产生的火焰是由其_____(填“固态”、“液态”或“气态”)物质燃烧形成的.
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合下列图示装置,回答下列问题.

(1)写出编号所指仪器的名称:①_____;②_____.
(2)利用AD装置制取氧气
①反应原理为_____(用化学方程式表示).装置A中试管口应略向下倾斜的原因是_____.
②为了使收集到的氧气较纯净,应等到_____时开始收集氧气.
(3)利用BC装置制取氧气:
①反应原理为_____(用化学方程式表示).选择装置B为发生装置的理由是_____.
②验证氧气收集满的方法是_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】模型与示意图是联系宏观与微观的桥梁.
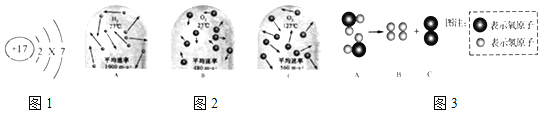
(1)如图1是氯原子的结构示意图.
①x的数值为_____.
②氯原子在化学反应中总易得到1个电子,形成_____(填离子符号).
(2)如图2是氢分子和氧分子运动的示意图.
①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是_____(填标号).
②从图中可见,影响分子运动速率的因素除温度外,还与_____有关.
(3)某物质A在通电时分解生成B和C,根据如图3微观结构示意图,写出其化学反应方程式:_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某饮用矿泉水1000g中的成分如图所示。
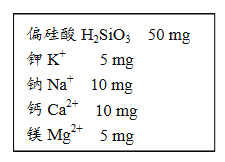
(1)此矿泉水中至少含有 种元素。
(2)在偏硅酸H2SiO3中,氢元素与氧元素的质量比为 。
(3)在偏硅酸H2SiO3中,求算硅元素的质量分数的计算式为 。
(4)某同学喝了500 g该矿泉水,他同时摄入的钾元素的质量为 mg。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是甲、乙两组同学进行空气中氧气含量的测定实验探究.回答下列问题:
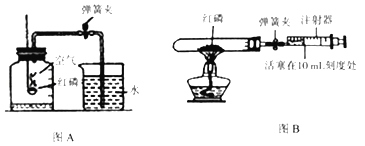
Ⅰ.甲组同学用图A装置进行实验.
(1)该实验过程中红磷需要过量,目的是_____,该反应的化学方程式为_____,其反应的基本类型属于_____反应.
(2)若将红磷换成炭粉,该实验能否获得成功?_____(填“能”或“不能”)成功,原因是_____.
Ⅱ.乙组同学用图B装置进行实验,选用容积为30mL的试管作为反应容器,实验步骤如下:
①将足量红磷装入试管中,将注射器活塞置于10mL刻度处,并按图B中所示的连接方式固定好,再将弹簧夹夹紧橡皮管.
②点燃酒精灯,给红磷加热.
③撤去酒精灯,待试管冷却后松开弹簧夹.
④读取注射器活塞的数据.
(1)充分冷却后打开弹簧夹,注射器活塞将从10mL刻度处慢慢向_____移动(填“左”或“右”)到约为_____mL刻度处才停止.若上述实验步骤①中,未用弹簧夹夹住橡皮管,其它步骤不变,则实验结束后注射器的活塞最终停在_____mL处刻度处.
(2)比较甲、乙两组实验,你认为乙组实验的优点是_____(答一点).
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钛(Ti)的合金具有耐高温,耐腐蚀、强度高等性能,所以,钛合金广泛用于航空、航天工业及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4,其反应化学方程式为:2FeTiO3+6C+7Cl2
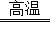 2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:
2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:(1)FeTiO3中钛元素的化合价为 价.
(2)在制备TiCl4的反应中,X的化学式为 .
(3)镁与TiCl4反应的化学方程式为: .
相关试题

