【题目】(1)控制变量,设计对比实验是实验探究的重要方法。
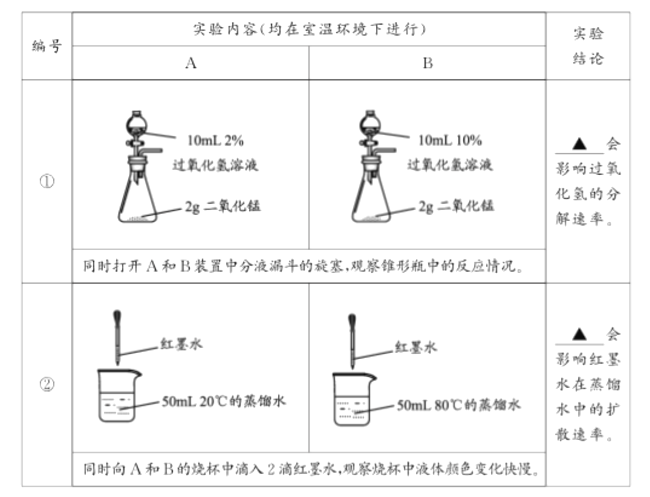
_______、_______
(2)观察是学习化学的重要方法。
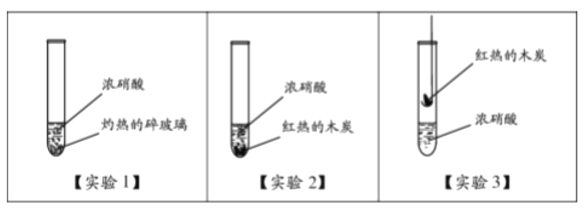
研究小组进行如下实验,发现均有红棕色二氧化氮气体产生。
查阅资料:4HNO3![]() O2↑+4NO2↑+2H2O
O2↑+4NO2↑+2H2O
C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
①(实验1)中所用碎玻璃与浓硝酸不发生化学反应,灼热的碎玻璃在实验中起到的作用是_______。
②(实验2)中有红棕色气体产生,能否证明(实验2)中木炭与浓硝酸发生了反应?请做出判断,并说明理由:________。
③(实验3)中发现红热的木炭表面有红棕色气体产生,且生成的气体产物中检测出二氧化碳(体积分数大于0.03%),能否证明(实验3)中木炭与浓硝酸发生了反应?请做出判断,并说明理由:______。
参考答案:
【答案】过氧化氢的浓度 温度 加热作用 不能,可能是灼热的木炭起加热作用,使硝酸受热分解产生的红棕色气体 不能,二氧化碳浓度升高,有可能是红热的木炭与氧气发生反应生成二氧化碳,虽然生成了红棕色的二氧化氮,也不能说明木炭一定与浓硝酸发生了反应
【解析】
(1)根据对照实验的控制变量分析;(2)①根据所用碎玻璃与浓硝酸不发生化学反应分析;②根据实验1的结论分析;③根据生成新物质(二氧化碳)分析。
(1)①同时打开A和B装置中分液漏斗的旋塞,观察锥形瓶中反应情况,装置B中的气泡比A多,过氧化氢溶液的浓度会影响过氧化氢的分解速率;②同时向A和B的烧杯中滴入2滴红墨水,观察烧杯中液体颜色变化快慢,结论是:温度会影响红墨水在蒸馏水中的扩散速率,故填:①过氧化氢溶液的浓度;②温度;
(2)①【实验1】中所用碎玻璃与浓硝酸不发生化学反应,灼热的碎玻璃在实验中起到的作用是加热作用;②【实验2】中有红棕色气体产生,不能证明【实验2】中木炭与浓硝酸发生了反应,因为是加热的木炭;③【实验3】中发现红热的木炭表面有红棕色气体产生,且生成的气体产物中检测出二氧化碳(体积分数大于0.03%),能证明【实验3】中木炭与浓硝酸发生了反应,因为有新物质二氧化氮和二氧化碳生成;故答案为:①加热;②不能证明【实验2】中木炭与浓硝酸发生了反应,因为是加热的木炭;③能证明【实验3】中木炭与浓硝酸发生了反应,因为有新物质二氧化氮和二氧化碳生成。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硝酸钾是实验室常见的一种试剂。
(1)硝酸钾是由___和___构成的(填写微粒符号)。
(2)硝酸钾中钾元素的质量分数是__________(结果用百分数表示,保留到0.1%)。
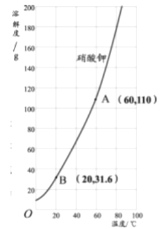
(3)右图是硝酸钾的溶解度曲线,由图可以总结出硝酸钾的溶解度随温度变化的趋势是_________。60℃时110g硝酸钾溶于100g水中形成的溶液是____(选填“饱和“或“不饱和”)溶液,将此时配得的溶液降温至20℃,析出硝酸钾晶体的质量是___g。
(4)列式计算:用100g10%的硝酸钾溶液配制5%的硝酸钾溶液。需要加水多少亳升____?(水的密度为1.0g·mL-1)
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是一门以实验为基础的科学,化学实验和科学探究离不开实验装置。
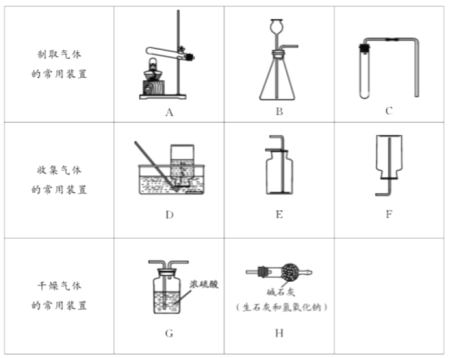
(1)制取气体实验时,首先要对发生的装置进行气密性检查,确保装置不漏气,装置C气密性检查的方法是______。
(2)收集某种气体的方法,主要取决于这种气体的性质,装置E所示的收集方法是____,被收集的气体密度_______空气密度(选填“>”,“<”,“=”)。
(3)实验室用大理石与稀盐酸制取并收集一瓶干燥的二氧化碳,所选装置正确的连接顺序是______→______→______(填装置编号)。
(4)下图所示一氧化碳与氧化铁的反应装置中,虚线方框内装置的作用有________________。
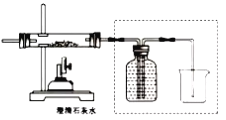
-
科目: 来源: 题型:
查看答案和解析>>【题目】从大理石(主要杂质是氧化铁)中提纯碳酸钙的一种实验流程如下:
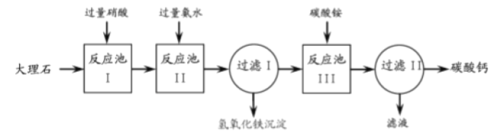
(1)反应池I中用硝酸不用稀硫酸的主要原因是______________。
(2)反应池II中加入氨水的目的是______________。
(3)反应池III用生成碳酸钙的化学方程式是______________。
(4)过滤II中所得滤液在农业生产中的一种用途是______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】探究碳酸氢钠、碳酸钠分别与稀盐酸反应,研究小组进行如下两个实验:
(1)(实验1)同时将足量的稀盐酸倒入锥形瓶甲和锥形瓶乙中。
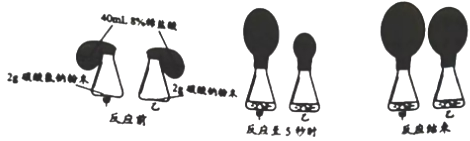
反应至5s生成气体的速率:碳酸氢钠___碳酸钠(选填“>”,“<”,“=”)。
(实验2)分别将足量的稀盐酸逐滴滴入试管甲和试管乙中,边滴边振荡。

现象为:
①试管甲中的溶液开始时显浅红色,逐滴滴入稀盐酸立即产生大量气泡,浅红色逐渐消失。
②试管乙中的溶液开始时显红色,滴入稀盐酸没有气泡产生,溶液颜色逐渐变为浅红色后,继续滴加稀盐酸有大量气泡产生,浅红色逐渐消失。
(2)(反思1)在(实验2)碳酸钠溶液中逐滴滴入稀盐酸,为何刚开始没有大量气泡产生?研究小组查阅资料,绘制出微观示意图。

①碳酸钠溶液中逐滴滴入稀盐酸,依次发生反应的化学方程式为_______、_______。
②相同浓度的碳酸氢钠溶液和碳酸钠溶液的碱性:碳酸氢钠_______碳酸钠(选填“>”,“<”,“=”)。
(3)(反思2)为何(实验1)中碳酸氢钠最终产生气体的体积较大?
请你列式计算:(实验1)中两种固体完全反应后产生气体的质量各是多少______(写出计算过程,结果保留到0.1g)?
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示的四个图像,能正确反映对应变化关系的是
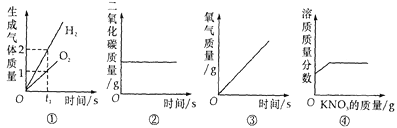
A. ①水的电解
B. ②木炭在密闭的容器内燃烧
C. ③加热一定量的高锰酸钾制氧气
D. ④20℃时,向一定量接近饱和的硝酸钾溶液中加入硝酸钾固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于水的说法中,正确的是( )
A. 自来水澄清透明,属于纯净物
B. 水覆盖了地球大约
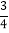 的表面,因此不存在水危机
的表面,因此不存在水危机C. 经济的发展、人口的增长,会造成淡水资源的紧张
D. 长期饮用纯净水,有益于身体健康
相关试题

