【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的化学方程式______________________________。
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________________。
(3)小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
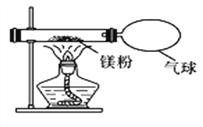
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
实验操作 | 实验现象及结论 |
_______________________ | ____________________ |
【实验探究】请设计实验,验证猜想(上表)。
【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________________ 。
参考答案:
【答案】 2Mg+O2![]() 2MgO 产生的氧化镁白烟扩散到空中去了 取黄色固体少许于试管中,加入适量水振荡,将湿润的红色石蕊试纸置于试管口 剧烈反应产生刺激性气体,湿润的红色石蕊试纸变蓝 该黄色物质是氮化镁,氧气的化学性质比氮气活泼
2MgO 产生的氧化镁白烟扩散到空中去了 取黄色固体少许于试管中,加入适量水振荡,将湿润的红色石蕊试纸置于试管口 剧烈反应产生刺激性气体,湿润的红色石蕊试纸变蓝 该黄色物质是氮化镁,氧气的化学性质比氮气活泼
【解析】(1)在点燃的条件下,镁与氧气反应生成氧化镁,反应的化学方程式为:2Mg+O2点燃2MgO;(2)所有的化学变化都遵循质量守恒定律,产生的氧化镁白烟扩散到空中去了;(3)根据题干信息,可将生成的固体物质放入水中,检验是否产生氨气来进行判断;具体实验操作:将镁条燃烧的产物放在一只试管中,加入少量的蒸馏水,然后将一湿润的红色石蕊试纸放在试管口,观察现象;若看到红色的石蕊试纸变成蓝色,说明黄色固体为氮化镁;【反思交流】氧气的化学性质比氮气更活泼,镁条更容易与氧气发生反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了减少大气污染,北京市积极推广使用清洁燃料—压缩天然气。天然气的主要成分是( )
A.甲烷B.氧气C.氮气D.二氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】在镁条燃烧实验中,最能说明该变化是化学变化的现象是
A.镁条变短
B.放出大量的热
C.发出耀眼的白光
D.生成白色固体
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组物质属于同种物质的是( )
A.水和冰B.金刚石和石墨C.红磷和白磷D.氧气和臭氧
-
科目: 来源: 题型:
查看答案和解析>>【题目】金刚石、石墨和C.60物理性质差异很大的原因是( )
A.构成它们的原子不同B.构成它们的碳原子相同,但碳原子排列方式不同
C.它们的组成不同D.它们的用途不同
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室将氯酸钾和二氧化锰的混合物7克放在一起加热制取氧气,充分反应后称得剩余固体的质量为5.08克。
求:(1)生成氧气的质量是______________克
(2)参加反应的氯酸钾的质量是__________?(根据化学方程式计算写出详细过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】酸雨给人类生活和社会发展带来了严重危害。汽车尾气是导致酸雨的重要原因,为减少有害气体的排放,人们在汽车排气管上安装“催化转化器”,使尾气中的一氧化碳和一氧化氮转化为空气中体积分数最多的气体和CO2。回答下列问题:
(1)写出转化的化学方程式:____________。
(2)化学反应中,元素的化合价升高,则该元素所在的反应物是还原剂,反之则为氧化剂。那么上述反应中的NO是____________剂。
(3)上述反应产生的CO2大量排放会导致____________,植树造林、低碳环保刻不容缓。
相关试题

