【题目】浴室喷头长时间使用会有白色固体附着,俗称水垢。这是因为硬水中含有较多的可溶性的碳酸氢钙【Ca(HCO3)2】,还含有可溶性的碳酸氢镁【Mg(HCO3)2】。查阅资料,加热时会产生难溶性的固体。其中碳酸氢钙【Ca(HCO3)2】受热易分解,生成难溶性的化合物、气体等物质。某小组想探究碳酸氢钙受热分解后产物的成分。
【提出猜想】猜想1.难溶性化合物可能是CaCO3;猜想2.气体可能是H2、CO、CO2 。
【方案设计】请你设计实验,帮助该组同学确定难溶物的成分。
实验步骤 | 实验现象 | 结论 |
_____ | _______ | 难溶物是CaCO3 |
【实验探究】该组同学设计如图实验,继续探究气体的成分。
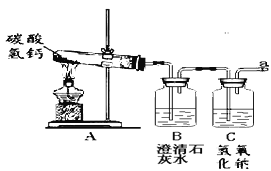
操作1.加热A装置,一段时间后,B装置中的澄清石灰水变浑浊。
操作2.在a处用燃着的木条检验,无明显现象。
【实验结论】结论1.碳酸氢钙分解产生的气体是____________;
结论2.碳酸氢钙受热分解的化学方程式为_____________________________。
【反思评价】有同学提出:硬水中可溶性的碳酸氢镁【Mg(HCO3)2】受热也会产生不溶性的固体,那水垢的成分中还有什么物质?根据上述探究,该组同学设计如下图装置进一步实验。(已知碱石灰主要成分为CaO和NaOH)
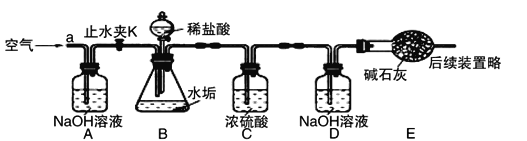
【实验测定】 步骤如下:
①按图组装仪器,先_____________,再将50g水垢样品放入锥形瓶中。
②打开止水夹K,从导管a处缓缓鼓入一定量的空气。
③逐滴加入足量稀盐酸,待锥形瓶中出现气泡不再产生现象时,停止滴加稀盐酸。
④打开止水夹K,从导管a处缓缓鼓入一定量的空气;
⑤称量D瓶内物质增加的质量,直至D瓶内物质质量不变;
⑥测量滴加稀盐酸体积与D瓶内物质增加质量的关系如下图曲线所示。
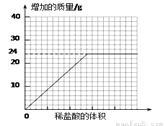
【讨论交流】
①A装置中的NaOH溶液的作用是____________________,若没有A装置,D装置中的质量将_______________(填“偏大”、“不变”或“偏小”)。
②C装置中浓硫酸的作用是__________________,E装置的作用是____________________。
③分析曲线图,通过计算可知:水垢中一定含有(化学式)________,理由是________________。
④查阅资料:水垢的主要成分有CaCO3、MgCO3和Mg(OH)2三种成分,三种物质加热后均能生成两种氧化物。小组同学提出探究水垢中氢氧化镁的质量分数:另取质量为50g的水垢试样,放入试管中加热至质量不再减少为止,测得二氧化碳24 g,残留固体25.1g。结合以上数据,确定水垢样品中氢氧化镁的质量分数为_______________。(结果保留小数点后一位)
参考答案:
【答案】 取样,滴加稀盐酸 有气泡产生 CO2 Ca(HCO3)2 ![]() CaCO3 ↓+ CO2↑+H2O 检查装置气密性 吸收鼓入空气中的二氧化碳 偏大 吸水干燥 吸收外界空气中CO2 和H2O MgCO3 (或CaCO3和MgCO3) 若只有CaCO3则50g只能生成CO222g,测定生成的CO224g,则一定还有MgCO3 5.8%
CaCO3 ↓+ CO2↑+H2O 检查装置气密性 吸收鼓入空气中的二氧化碳 偏大 吸水干燥 吸收外界空气中CO2 和H2O MgCO3 (或CaCO3和MgCO3) 若只有CaCO3则50g只能生成CO222g,测定生成的CO224g,则一定还有MgCO3 5.8%
【解析】 (1).碳酸盐能与酸反应生成二氧化碳,所以 取样,滴加稀盐酸,有气泡产生,可证明难溶物是CaCO3; (3). .碳酸氢钙分解产生气体CO2 、碳酸钙、水;反应方程式为:Ca(HCO3)2 ![]() CaCO3 ↓+ CO2↑+H2O ; (5). 做实验时要先检查装置气密性,然后再加入药品; (6). A装置中的NaOH溶液的作用是吸收鼓入空气中的二氧化碳,因二氧化碳和氢氧化钠反应生成碳酸钠和水; (7). 若没有A装置,D装置将吸收空气中的二氧化碳,导致质量偏大 (8). 浓硫酸有吸水性,可吸水干燥二氧化碳; (9). E装置的作用是吸收外界空气中CO2 和H2O ;D装置中的质量将吸收空气中的二氧化碳,导致质量偏大 (10). 水垢的成分是碳酸钙和氢氧化镁;每碳酸钙完全反应生成44g二氧化碳,每84g碳酸镁完全反应生成44g二氧化碳,因为若只有CaCO3则50g只能生成CO222g,测定生成的CO224g,则一定还有MgCO3 (12). 碳酸镁在加热条件分解生成氧化镁和二氧化碳,碳酸钙在加热条件下生成二氧化碳和氧化钙,氢氧化镁加热条件下分解生成氧化镁和水;所以加热后减少的是水的二氧化碳的总量;质量为50g的水垢试样,放入试管中加热至质量不再减少为止,残留固体25.1g ,则生成二氧化碳和水的总量为:50g-25.1g=24.9g,测得二氧化碳24 g,所以水的质量为0.9g。氢氧化镁可看做MgOH2O,氢氧化镁的质量为:0.9g÷(18÷58×100%)=2.9g;水垢样品中氢氧化镁的质量分数为2.9g ÷50g×100%=5.8%。
CaCO3 ↓+ CO2↑+H2O ; (5). 做实验时要先检查装置气密性,然后再加入药品; (6). A装置中的NaOH溶液的作用是吸收鼓入空气中的二氧化碳,因二氧化碳和氢氧化钠反应生成碳酸钠和水; (7). 若没有A装置,D装置将吸收空气中的二氧化碳,导致质量偏大 (8). 浓硫酸有吸水性,可吸水干燥二氧化碳; (9). E装置的作用是吸收外界空气中CO2 和H2O ;D装置中的质量将吸收空气中的二氧化碳,导致质量偏大 (10). 水垢的成分是碳酸钙和氢氧化镁;每碳酸钙完全反应生成44g二氧化碳,每84g碳酸镁完全反应生成44g二氧化碳,因为若只有CaCO3则50g只能生成CO222g,测定生成的CO224g,则一定还有MgCO3 (12). 碳酸镁在加热条件分解生成氧化镁和二氧化碳,碳酸钙在加热条件下生成二氧化碳和氧化钙,氢氧化镁加热条件下分解生成氧化镁和水;所以加热后减少的是水的二氧化碳的总量;质量为50g的水垢试样,放入试管中加热至质量不再减少为止,残留固体25.1g ,则生成二氧化碳和水的总量为:50g-25.1g=24.9g,测得二氧化碳24 g,所以水的质量为0.9g。氢氧化镁可看做MgOH2O,氢氧化镁的质量为:0.9g÷(18÷58×100%)=2.9g;水垢样品中氢氧化镁的质量分数为2.9g ÷50g×100%=5.8%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在H2、O2、CO、CO2和CH4五种气体中,①能在空气中燃烧的气体是 ;②能溶于水,其水溶液能使石蕊试液变成红色的气体是 ;③能使氧化铜还原成铜的化合物是 ;④有剧毒的是 ;⑤密度比空气大的 ;⑥能用排水法收集的是 .
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一个密闭容器中放入M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是
物 质
M
N
Q
P
反应前质量(g)
18
1
2
32
反应后质量(g)
X
26
2
12
A.反应后物质M的质量为l3g B.该变化的基本反应类型是分解反应
C.反应中N、P的质量比为5:4 D.物质Q可能是该反应的催化剂
-
科目: 来源: 题型:
查看答案和解析>>【题目】清凉油具有散热、醒脑、提神的功效,其主要成分为薄荷脑(化学式为C10H20O),下列有关薄荷脑的说法错误的是
A.薄荷脑是3种元素组成的化合物
B.1个薄荷脑分子中含有31个原子
C.薄荷脑中碳元素的质量分数大于氢元素的质量分数
D.薄荷脑中碳、氢元素的质量比为1:2
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下列实验常用装置,回答有关问题。
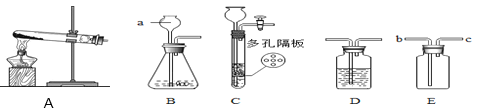
(1)写出图中标有字母的仪器的名称:a___________。
(2)若用A装置制氧气,其反应的化学方程式为_______________________,在制取氧气时试管中的棉花没有发生燃烧,根据燃烧的条件分析,其主要原因是_________________。 若要制取二氧化碳,其化学方程式为___________________________ 。 若要获得干燥的二氧化碳,除发生装置外,还应选用D装置,并在该装置中盛放_______________________(填写试剂名称)。
(3)实验室常使用仪器E来收集气体,如现在要收集氢气,则气体从____端进入(填“b”或“c”),有同学认为只要经过一定的改进措施,氧气也能从该端进入收集,则他的改进措施是________________。
(4)某化学兴趣小组设计实验甲、乙(装置如下图)探究二氧化氮气体能否使带火星木条复燃。
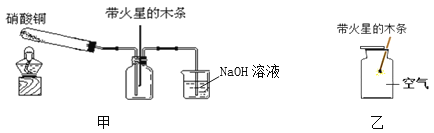
【资料】Ⅰ.硝酸铜加热分解生成氧化铜、红棕色二氧化氮气体(有毒)和氧气。
Ⅱ.同温同压下,不同气体的体积之比等于分子个数之比。
①甲实验中硝酸铜加热分解的化学方程式为__________________,NaOH溶液的作用 是____________。
②根据实验过程中的____________________现象得出“NO2能使带火星木条复燃”的结论。请你从气体
的组成角度分析,该结论正确的理由是________________________。
-
科目: 来源: 题型:
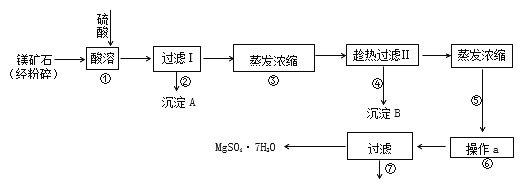
查看答案和解析>>【题目】某种镁矿石的主要成分是碳酸镁,还含有较多的脉石(SiO2)和少量石灰石。下图是利用该镁矿石制备七水硫酸镁(MgSO4·7H2O)的工艺流程:
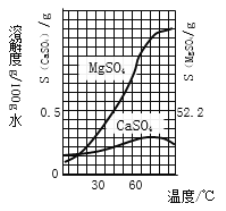
已知 CaSO4和MgSO4的溶解度曲线如下图所示:
根据以上信息回答下列问题:
⑴写出步骤①中碳酸镁与硫酸发生反应的化学方程式________________________。
⑵上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和_______。
⑶沉淀A的成分是SiO2和部分硫酸钙,过滤I后得到的滤液中的溶质除了MgSO4还有___________。
⑷步骤④趁热过滤的作用是____________________________________。
⑸步骤⑥的操作a名称是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活与化学密切相关。食盐、酒精、水、铁粉、食醋是生活中常见的物质,请按下列要求填空。
(1)鉴别酒精和水,最简便可行的方法是_________________。
(2)以上物质中,可用于清除水垢的是__________,可用作食品干燥剂的是__________,可用作调味剂和防腐剂是__________。
相关试题

