【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某兴趣小组同学在课外进行了有关过氧化氢分解反应的再探究。
(查阅资料)催化剂指的是能够改变化学反应的速率而自身的质量和化学性质在化学反应前后均不发生变化的物质。
(探究一)影响过氧化氢分解速率的因素有哪些?
兴趣小组同学做了四个实验,实验数据如下表:
实验 序号 | H2O2溶液的溶质质量分数% | H2O2溶液的体积/mL | 温度/℃ | MnO2的用量/g | 收集O2的体积/mL | 反应 时间 |
① | 5 | 1 | 20 | 0.1 | 4 | 16 s |
② | 15 | 1 | 20 | 0.1 | 4 | 6 s |
③ | 30 | 5 | 35 | 0 | 4 | 98 min |
④ | 30 | 5 | 55 | 0 | 4 | 20min |
(1)过氧化氢分解速率与温度的关系是__________。
(2)能说明过氧化氢的分解速率与其质量分数有关的实验是__________(填实验序号)。
(探究二)MnO2的聚集状态是否影响其催化效果?
将质量相同但聚状态不同的MnO2分别加入到5mL5%的H2O2溶液中,测试结果如下:
MnO2的状态 | 操作情况 | 观察结果 |
粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 |
块状 | 反应较慢,火星红亮但木条未复燃 |
由上述实验得到的结论是__________。
(探究三)其他金属氧化物能否起到类似MnO2的催化作用?
兴趣小组同学用天平称量0.2gCuO,用量筒量取5mL5%的H2O2溶液,进行如下图所示实验(①~⑦代表实验操作步骤)。

(1)小组同学通过上述实验得出结论:CuO可作过氧化氢分解的催化剂,支持该结论的实验证据是__________。
(2)过氧化氢能被CuO催化分解放出氧气的化学反应方程式为__________。
(3)欲比较不同催化剂CuO和MnO2对H2O2分解速率的影响,实验时需要控制的变量有__________。
参考答案:
【答案】 其他条件相同时,温度升高,过氧化氢分解速率加快 ①② 粉末状二氧化锰比块状二氧化锰催化效果要好 ①不复燃,③复燃;⑥固体质量为0.2 g;⑦复燃。 2H2O2 ![]() 2H2O + O2↑ 温度、H2O2溶液溶质质量分数及体积、CuO和MnO2的质量及聚集状态。
2H2O + O2↑ 温度、H2O2溶液溶质质量分数及体积、CuO和MnO2的质量及聚集状态。
【解析】本题考查了影响化学反应速率的因素探究,催化剂的特点。在探究外界条件对反应速率的影响时,要注意分析其他条件相同,只有一个条件改变时,如何影响反应速率。
探究一:(1)根据控制变量的试验方法,选取数据③和④可知,其他条件相同时,温度升高,过氧化氢分解速率加快;
(2)①和②中,除了过氧化氢溶液的溶质质量分数不同,其他条件相同,由数据可知产生等体积的氧气,溶质的质量分数越大,所需时间越短;故选①②;
探究二:由实验现象可知,在其他条件相同的情况下,粉末状的二氧化锰能使过氧化氢溶液的分解速率更快;这说明了粉末状二氧化锰比块状二氧化锰催化效果要好;
探究三:(1)步骤①中带火星的木条不复燃,说明常温下,过氧化氢溶液分解很缓慢;步骤③中的现象是有气泡产生,带火星的木条复燃,与步骤①对比说明氧化铜能加快过氧化氢的分解速率;步骤⑥中称量的氧化铜的质量仍为0.2g,说明氧化铜在反应前后质量不变;⑦的现象是溶液中有气泡放出,带火星的木条复燃,说明氧化铜在反应前后化学性质不变;催化剂是能改变化学反应的速率,而本身的质量和化学性质不变的物质。实验现象①不复燃,③复燃;⑥固体质量为0.2 g;⑦复燃,能得出CuO可作过氧化氢分解的催化剂。
(2)在氧化铜的催化作用下,过氧化氢分解为水和氧气,化学方程式是2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)欲比较不同催化剂CuO和MnO2对H2O2分解速率的影响,除了催化剂的种类不同以外,实验时需要控制的变量有温度、H2O2溶液溶质质量分数及体积、CuO和MnO2的质量及聚集状态。
-
科目: 来源: 题型:
查看答案和解析>>【题目】按照如图所示进行中和反应实验。
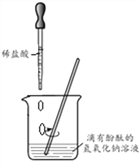
(1)反应的化学方程式为__________。
(2)向烧杯中逐滴滴入盐酸至过量,在这个过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是____。
(3)实验后溶液pH__(填“小于”“等于”或“大于”)7。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验小组同学通过以下实验研究二氧化碳的性质。
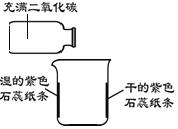
①在烧杯内壁上贴上干的和用水润湿的紫色石蕊纸条
②将充满二氧化碳的集气瓶轻轻在烧杯上方倾斜
一段时间后,湿的紫色石蕊纸条变为红色
(1)烧杯内壁上贴干的紫色石蕊纸条的目的是__________。
(2)该实验发生反应的化学方程式为__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】二氧化钛(TiO2)是许多反应的催化剂。工业上用钛铁矿(主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2(不与H2SO4反应且不溶于水))作原料,制取二氧化钛及绿矾(FeSO4·7H2O),其生产流程如下:
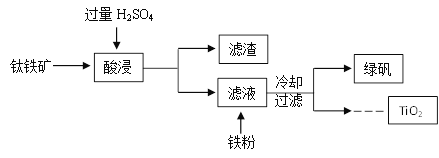
(1)TiO2中钛元素的化合价为__________。
(2)加入铁粉,发生置换反应的化学方程式为__________。
(3)以TiO2为原料还可以制取金属Ti。请将其中的一步反应的化学方程式补充完整:TiO2+2Cl2+C=TiCl4 +__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了帮助同学们更好的理解空气中氧气含量测定的实验原理,老师利用传感器技术实时测定了实验装置(如图1)内的压强、温度和氧气浓度,三条曲线变化趋势如图2所示。
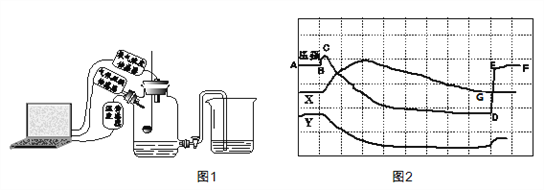
(1)Y曲线表示的是__________(填“温度”或“氧气的浓度”)。
(2)从图中哪里可以看出降至室温时打开的旋塞? __________
(3)从图中哪里可以看出集气瓶中的氧气并没有消耗到0? __________
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的下列用途主要利用其化学性质的是




A.液氧(支持燃烧)
B.金属铜(制电线)
C.活性炭(做防毒面具的吸附剂)
D.不锈钢(做水壶)
A. A B. B C. C D. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关说法正确的是
A. 氧气、二氧化碳和过氧化氢三种物质中都含有氧分子
B.
 表示的粒子都是阴离子
表示的粒子都是阴离子C. 打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
D. 硝酸钾、氯化钠和硫酸铵三种物质在pH=10的溶液中能大量共存
相关试题

