【题目】我国每年报废的手机超过1亿部。废旧手机的电路板中含有铝、铁、铜、银、金等多种金属,随意丢弃既会造成资源浪费,也会污染土壤和水体。化学兴趣小组为回收其中的铜,设计并进行了如下实验。

已知:Cu+H2O2+H2SO4=CuSO4+2H2O;不考虑金、银发生类似反应。
(1)将电路板粉碎成粉末的目的是_____________。
(2)步骤①所得滤液中的溶质除硫酸外,还有_________________。(用化学式填空)
(3)步骤②中的实验现象是:固体部分溶解,________________。
(4)步骤④中反应的化学方程式是_______________。
参考答案:
【答案】 增大接触面积,使反应更充分(加快反应速率)(合理即可) FeSO4和Al2(SO4)3 溶液由无色变为蓝色或溶液变为蓝色 Fe+H2SO4=FeSO4+H2↑
【解析】(1)将电路板粉碎成粉末的目的是增大反应物之间的接触面积,使反应更充分。(2) Fe+ H2SO4 == FeSO4 + H2↑,2Al+3H2SO4 = Al2(SO4)3+3H2↑,FeSO4、Al2(SO4)3都易溶于水形成溶液,故步骤①所得滤液中的溶质除硫酸外,还有FeSO4和Al2(SO4)3。(3)步骤①后,过滤,滤渣中含有铜、银、金,向滤渣中加入足量稀硫酸和过氧化氢溶液,Cu+H2O2+H2SO4=CuSO4+2H2O,金、银与加入的溶液不反应,加入的溶液无色,生成的CuSO4溶液是蓝色的,故步骤②中的实验现象是:固体部分溶解,溶液由无色变为蓝色。(4)步骤③后,过滤,滤渣中含有Fe、Ag、Au,加入过量稀硫酸,Ag、Au都不与稀硫酸反应,Fe能与稀硫酸反应:Fe+H2SO4=FeSO4+H2↑
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素家族新成员——鉨(
 )
)2016年6月8日,国际纯粹与应用化学联合会正式发布113号等四种新元素的英文名称和元素符号。2017年5月9日,我国发布了这四种元素的中文名称。其中113号元素的元素符号为Nh,中文名称为“鉨”。图1中,甲为鉨原子结构示意图,乙为铝原子结构示意图。请回答下列问题;
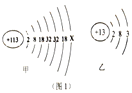
(1)甲中x=________。
(2)鉨元素的原子与铝元素的原子具有相同的_____________数。
(3)在化学反应中,鉨原子形成离子的符号为___________。
(4)根据鉨和铝的结构,理论上鉨的金属活动性比铝强,试预测鉨可能与哪些物质反应? ________,________。(写出两种不同类别的物质的化学式即可)
-
科目: 来源: 题型:
查看答案和解析>>【题目】质量守恒定律的发现对化学的发展作出了巨大贡献。
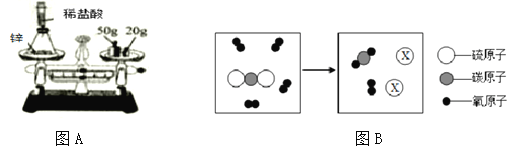
(1)为验证质量守恒定律,小华设计如上图所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至2.6g,天平平衡(如上图A所示)。然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到总质量为__________g,从而验证了质量守恒定律,反应的化学方程式为___________________,若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是__________________。
(2)某反应的微观示意图,如图B所示。
①X的化学式是_______。
②从微观角度分析, 在化学反应前后一定不变的是____________(选填序号)。
a原子种类 b分子种类 c元素质量 d分子质量 e分子数目
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的部分装置,请根据实验装置(部分固定装置已省略)回答问题:
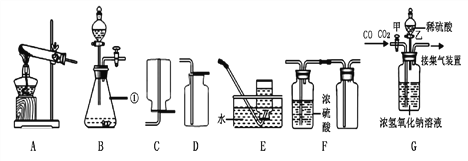
(1)图中标识①仪器的名称是________
(2)实验室既可以制取CO2,又可以制取O2的发生和收集装置组合为:________(在A—E中选),用该装置制取CO2的化学方程式为:__________________________________
(3)若用F装置收集一瓶干燥的某气体,则该气体可能是________(填字母代号)。
A. NH3 B. H2 C. O2 D.CH4
(4)工业上常需分离CO和CO2的混合气体。某同学采用装置G也能达到分离该混合气体的目的,操作步骤如下:
①关闭活塞乙,打开活塞甲,通入混合气体,可收集到________气体(填化学式);②然后,_____________(填操作),又可收集到另一种气体。
-
科目: 来源: 题型:
查看答案和解析>>【题目】归纳总结是学习化学的重要方法,某化学兴趣小组学习碱的性质后,通过实验对氢氧化钙的化学性质进行了验证和总结,如图所示-——表示物质两两之间能发生化学反应。请根据如图,回答问题。(已知:CaCl2溶液呈中性,CaCl2+Na2CO3═CaCO3↓+2NaCl)


(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈_________________(填“酸性、碱性或中性”)。
(2)乙同学将过量的稀盐酸加入到甲同学所得溶液中,观察到的现象是________________,此时含有的溶质有________(酸碱指示剂除外)(用化学式填空,下同)。
(3)为验证乙同学所得溶液中含有的溶质,可取少量反应后的溶液滴加过量的____________溶液(填一种物质的化学式),产生_______________________________现象,则证明存在。
-
科目: 来源: 题型:
查看答案和解析>>【题目】同学们利用如图所示的装置,对质量守恒定律进行了探究。实验结束后,老师另外提出了几个问题,请你一起参与思考。
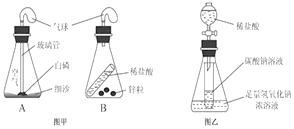
(1)图甲装置内物质充分反应后,冷却至室温,气球仍胀大的是______(选填“A”、“B”或“A 和 B”)。
(2)若图乙装置内Na2CO3溶液的质量为5克,滴入试管的稀盐酸质量也是5克,装置内物质充分反应后,发现NaOH浓溶液质量增加0.22克,试管中滴入紫色石蕊试液变红。根据上述已知条件,通过分析可以确定的是_________(选填序号)
①原稀盐酸的溶质质量分数
②原Na2CO3溶液的溶质质量分数
③原NaOH溶液的溶质质量分数
④反应后试管中NaCl的溶质质量分数
请你选择所填的其中一项,通过计算确定其溶质质量分数是__________?(若不能完全整除,计算结果保留0.1%)
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示是一把铁制剪刀。它的下列自述中一定涉及化学变化的是
A.我的造型既特殊又美观
B.我能剪出各式各样的服饰
C.我经过磨砺会更加锋利
D.我惧怕潮湿的空气,在那里我会变得十分难看
相关试题

