【题目】实验室有一包纯净的铁粉,小明为了探究金属的化学性质并测定铁的相对原子质量,设计了如图的实验。
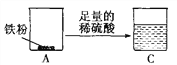

【实验步骤】
①取两份质量同为wg的铁粉,分别置于质量相等的A、B烧杯中。
②向装有铁粉的A烧杯中加入50 g足量的稀硫酸;向装有铁粉的B烧杯中加入50 g足量的硫酸铜溶液。
③充分反应后进行称量。C烧杯和烧杯内物质的总质量为mg,D烧杯和烧杯内物质的总质量为ng。
(1)请写出C烧杯中发生反应的化学方程式:___________。通过C烧杯中发生的化学反应,你能得出的结论是_______。
(2)D烧杯中发生反应的化学方程式为______________。此反应可以证明铁的金属活动性比铜_______(填“强”或“弱”)。
(3)铁的相对原子质量的表达式为_______。
参考答案:
【答案】 Fe+H2SO4=FeSO4+H2↑ 铁能置换出酸中的氢 Fe+CuSO4=FeSO4+Cu 强 ![]()
【解析】(1)铁的活动性在氢前,所以铁能与稀硫酸反应生成氢气和硫酸亚铁,其方程式为Fe+H2SO4═FeSO4+H2↑;(2)由金属活动性顺序表可知铁的活动性比铜强,所以铁能置换出硫酸铜中的铜,其方程式为CuSO4+Fe═FeSO4+Cu;(3)因为D烧杯中反应后物质的总质量是n克,而依据质量守恒定律可知反应后D烧杯中物质的总质量是(50+w)克,所以烧杯的质量为:n克-(50+w)克;所以铁与稀硫酸的反应生成氢气的质量是50克+w克-{m克-[n克-(50+w)克]}=(n-m)克
设铁的相对原子质量是x
Fe+H2SO4═FeSO4+H2↑
x 2
wg (n-m)g![]()
x=![]()
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列是甲、乙两组同学进行空气中氧气含量的测定实验探究.回答下列问题:
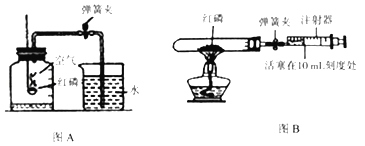
Ⅰ.甲组同学用图A装置进行实验.
(1)该实验过程中红磷需要过量,目的是_____,该反应的化学方程式为_____,其反应的基本类型属于_____反应.
(2)若将红磷换成炭粉,该实验能否获得成功?_____(填“能”或“不能”)成功,原因是_____.
Ⅱ.乙组同学用图B装置进行实验,选用容积为30mL的试管作为反应容器,实验步骤如下:
①将足量红磷装入试管中,将注射器活塞置于10mL刻度处,并按图B中所示的连接方式固定好,再将弹簧夹夹紧橡皮管.
②点燃酒精灯,给红磷加热.
③撤去酒精灯,待试管冷却后松开弹簧夹.
④读取注射器活塞的数据.
(1)充分冷却后打开弹簧夹,注射器活塞将从10mL刻度处慢慢向_____移动(填“左”或“右”)到约为_____mL刻度处才停止.若上述实验步骤①中,未用弹簧夹夹住橡皮管,其它步骤不变,则实验结束后注射器的活塞最终停在_____mL处刻度处.
(2)比较甲、乙两组实验,你认为乙组实验的优点是_____(答一点).
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属钛(Ti)的合金具有耐高温,耐腐蚀、强度高等性能,所以,钛合金广泛用于航空、航天工业及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4,其反应化学方程式为:2FeTiO3+6C+7Cl2
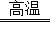 2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:
2TiCl4+2X+6CO,然后用镁与TiCl4在高温条件下反应生成金属钛和氯化镁.请根据以上信息回答下列问题:(1)FeTiO3中钛元素的化合价为 价.
(2)在制备TiCl4的反应中,X的化学式为 .
(3)镁与TiCl4反应的化学方程式为: .
-
科目: 来源: 题型:
查看答案和解析>>【题目】人类的生产生活离不开金属材料.
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属__的位置移到最后,正好符合由弱到强的__顺序.
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属.如图1所示用品中,利用金属导热性的是__,延展性的是__(填字母序号).

(3)铜也容易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和__共同作用的结果.
(4)合金是由两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质.一般来说,合金的熔点低于任何一种组成金属的熔点.下表是一些金属的熔点数据.
金属
铜
锌
锡
铅
铋
镉
熔点/℃
1083
419.6
231.9
327.5
271.3
320.9
①铅锡合金中某种金属的质量分数与合金的熔点有如图2所示的关系,其中横坐标表示的是__的质量分数;当合金熔点最低时,合金中铅与锡的质量比为__.
②保险丝由铋、铅、锡、镉组成,其熔点约为__.
A.15~30℃; B.60~80℃; C.235~250℃; D.300~320℃.
-
科目: 来源: 题型:
查看答案和解析>>【题目】用金属铁制备自来水的新型消毒、净水剂K2FeO4的流程如下:
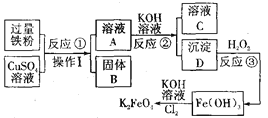
请回答下列问题:
(1)固体B的成分是_______(用符号表示)。
(2)操作I的名称是_______;操作I所需要的仪器和用品:铁架台、玻璃仪器、试剂、_______(填一种实验物品名称)。
(3)反应①、②、③中没有涉及的化学反应类型是_______(填字母代号)。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(4)请书写以下反应的化学方程式:反应②_____________________。反应③_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下表信息回答:

说明:导电性以银的导电性为100作标准,硬度以金刚石的硬度为10作标准。
(1)菜刀用铁做而不用铝做的主要原因是______________。
(2)表中导电性最强的金属是_______。
(3)①中形成薄膜的化学方程式为______________。
(4)金属的冶炼体现了人类文明的发展水平,之所以有先后,主要取决于_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如下图所示的实验操作。其中可以达到实验目的的组合是
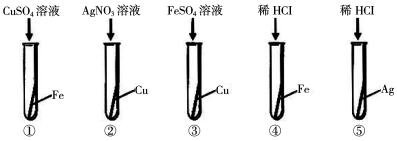
A.①③ B.②④ C.④⑤ D.②③
相关试题

