【题目】某固体混合物A中含Fe2O3、Na2CO3、NH4Cl 、Ba(NO3)2、K2SO4中的两种或多种。小方同学按下图所示进行了样品组成的探究实验,观测现象如图中所述:(设过程中所有可能发生的反应都恰好完全进行)。)
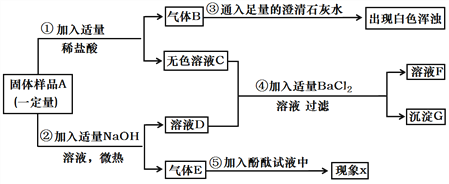
根据上述信息进行分析和推理,并回答下列问题:
(1)气体B的化学式为________,现象X是__________。
(2)固体混合物A中,肯定不存在的物质是____________(填化学式)。
(3)写出步骤②中发生反应的化学方程式_____________________________。
(4)溶液F中,存在的金属阳离子是______________(填离子符号)。
(5)根据步骤④中的实验现象,小方同学推测固体A中一定含有K2SO4,你是否意他的观点_____________(填“是”或否)。请你设计实验方案,以沉淀G为试样,进一步确定固体A中是否存在K2SO4?请简述实验操作、现象及结论:____________________。
参考答案:
【答案】 CO2 溶液变红色 Fe2O3、Ba(NO3)2 NH4Cl+NaOH△NaCl+H2O+NH3↑ Na+ 否 取少量沉淀G于试管中,加入足量稀硝酸,(或稀盐酸,若答稀硫酸不给分)若沉淀全部溶解,则沉淀G中无BaSO4,即固体A中没有K2SO4;若沉淀部分溶解,则沉淀G中有BaSO4,即固体A中有K2SO4。
【解析】混合物A加入稀硫酸,会生成气体B和无色溶液C,所以混合物A中一定含有碳酸钠,一定没有氧化铁,B是二氧化碳,一定不含硝酸钡,硝酸钡和稀硫酸会生成硫酸钡沉淀,混合物A中加入氢氧化钠,得到气体E和溶液D,则气体E是氨气,在D和C的混合溶液中加入氯化钡产生白色沉淀,此沉淀可能是碳酸钡,也可能是硫酸钡,所以:(1)气体B的化学式为CO2;氨气溶于水形成氨水并显碱性,能使酚酞溶液变红;(2)在混合物A里,肯定存在的物质是:Fe2O3、Ba(NO3)2;(3)步骤②中发生反应的化学方程式:NH4Cl+NaOH△NaCl+H2O+NH3↑;(4)在溶液F中,一定大量存在的金属阳离子是Na+;(5) 在D和C的混合溶液中加入氯化钡产生白色沉淀,此沉淀可能是碳酸钡,也可能是硫酸钡;检验的方法是:取少量沉淀G于试管中,加入足量稀硝酸,(或稀盐酸)若沉淀全部溶解,则沉淀G中无BaSO4,即固体A中没有K2SO4;若沉淀部分溶解,则沉淀G中有BaSO4,即固体A中有K2SO4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】清华大学研究人员成功研出一种纳米纤维催化剂,可将二氧化碳催化转化成液体燃料甲醇,下图为该反应的微观模拟示意图(图中微粒恰好完全反应)。下列有关说法正确的是( )
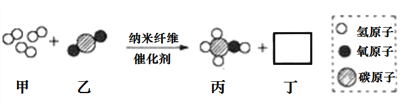
A. 该反应类型为复分解反应
B. 参加反应的甲、乙质量之比为3:1
C. 生成物丙和丁均为氧化物
D. 该反应实现了无机物到有机物的转化
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)物质分类是化学研究的常用方法,请按要求从氧气、二氧化碳、甲烷、硫酸钾、盐酸、氢氧化钠六种物质中,选择合适的物质,将其化学式填写在下列横线上:
①最简单的有机物______________ ②胃酸的主要成分_________
③能作制冷剂的氧化物__________ ④可用作肥料的盐________
(2)化学来源于生活,同时服务于生活。请你运用所学的化学知识,回答下列问题:
①中药是我国宝贵的文化遗产之一,它可用于治疗和预防许多疾病,主要包括植物药、动物药、矿物药。已知中药八角中富含莽草酸,其化学式为C7H10O5,这是治疗流感药物的关键生产原料。从物质分类角度看莽草酸属于________(选填“混合物”、氧化物”、“无机物”、“有机物”之一),其中,碳、氢元素的质量比为_________(填最简整数比)。
②今年5月31日是第31个世界无烟日,宣传主题是“烟草和心脏病”。烟草中含有尼古丁C10H14N2、苯并芘C20H12等剧毒物质,这两种物质中所含氢元素的质量分数是前者_____后者(选填“大于”、“小于”,“等于”之一)。
③2017年5月18日,我国南海神孤海域的可燃冰试采取得圆满成功,实现了历史性突破。可燃冰又称天然气水合物,主要成分是甲烷,还含有乙烷(C2H6)、丙烷(C3H8)等物质。
试写出丙烷在空气中完全燃烧的化学方程式:______________________________。
④化学与我们的生活密切相关。下列有关说法错误的是__________(填序号之一)。
A.“珍爱生命,拒绝毒品”是我们每个公民的责任
B.为预防甲状腺肿大,应在食盐中添加适量碘元素
C.煤气泄露应立即开窗通风,关闭阀门
D.油锅着火可以立即用冷水浇灭
-
科目: 来源: 题型:
查看答案和解析>>【题目】水及溶液与人类的生活生产密切相关。根据下列图示,请回答相关问题。
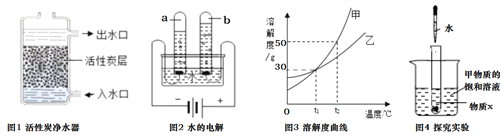
(1)图1中,活性炭净水器主要利用了活性炭具有的_______性;图2所示实验中,试管b中得到的气体是(写物质名称)_______。
②图3为甲、乙两种固体物质的溶解度曲线图。t1℃时,甲物质的溶解度是_________,t2℃时,甲的饱和溶液溶质质量分数_________乙的饱和溶液溶质质量分数(填“大于”、“等于”、“小于”之一);图4所示实验中,将水滴入盛有物质X的小试管中,可观察到烧杯中有甲物质的固体析出。则物质X可能是_________(填序号之一)。
A.食盐 B.烧碱 C.生石灰 D.硝酸铵
(3)海水中蕴着丰富的物物质资源。
①我国海盐年产量居世界第一位。目前从海水中提取食盐的方法主要为“盐田法”,生产流程如下图所示:
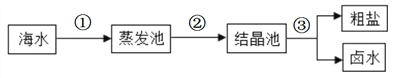
在蒸发池中促进水分蒸发,主要是利用了_________(填序号之一)。
A.潮沙汐能 B,生物能 C.电能 D.太阳能
上述流程中得到的卤水,是氯化钠的________溶液(填“饱和”或“不饱和”)。
②金属镁广泛应用于生活、生产和国防工业,从海水或卤水中提取镁的工艺流程如下图所示:
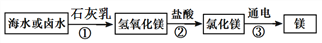
在上述转化过程,步骤①得到氢氧化镁固体的操作名称是___________,步骤②中发生反应的化学方程式为____________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图所示为实验室常见气体制备、净化、干燥、收集和性质实验的部分仪器。(组装实验仪器时,可重复选择仪器),某校化学小组欲用它们完成各自的探究实验。
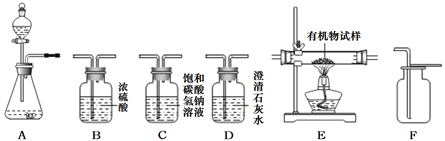
(1)第一组同学以石灰石和稀盐酸为原料,在实验室中制备并收集一瓶干燥、纯净的二氧化碳气体,按照要求设计实验装置、连接仪器,并检验装置的气密性。
(提示:挥发出的少量HCl气体可用饱和碳酸氢钠溶液去除)
①所选仪器的连接接顺序为__________(写仪器序号字母)。
②制取二氧化碳所发生反应的化学方程式为______________________。
③若将制得的二氧化碳通入足量的饱和澄清石灰水中,恰好完全反应时,所得溶液的质量将比之前溶液的质量__________(“变大”,“受"“不之一)。其原因是_______________。
④下列关于二氧化碳制取和性质的叙述中,不正确的是_________(填序号之一)。
A.二氧化碳碳能溶于水且与水反应,所以通常不采用排水法来收集
B.二氧化碳既不能燃烧,也不支持燃烧,所以可用于灭火
C.二氧化碳的水溶液能使紫色石蕊试液变红,所以二氧化碳是酸
D.通过分液漏斗可以控制稀盐酸的滴入量,从而控制反应速率
(2)第二组同学以过氧化氢溶液为原料(MnO2为催化剂)制备氧气,并对某有机物的组成元素进行分析探究(已知有机物只含C、H两种元素),所选仪器按A→B1→E→B2→D→碱石灰干燥管的顺序连接,(B1、B2为浓硫酸洗气瓶),实验前检验装置气密性。使该有机物在纯氧气中充分燃烧,观察现象,收集有关实验数据(假设发生的化学反应都充分反应)。试回答下列问题:
①装置A中发生反应的化学方程式为:____________________________。
②装置E中的玻璃管内放入一定质量的有机物试样,将其充分燃烧后,测得装置B2质量增加ag,则该有机物样品中,氢元素的质量为___________(计算结果用含字母的代数式表示)。
③上述实验中,装置B1的作用是____________________。若没有连接装置B1(其他仪器连接顺序不变),这样测算出的有机物中氢元素的质量分数与实际值比较将_____________(填“偏大”、“偏小”、“基本一致”之一)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)某化学兴趣小组的同学欲利用废铜制取硫酸铜,设计了如下两个实验方案
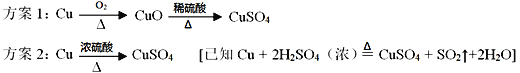
从绿色化学的视角考虑,你认为哪一个方案更合理?方案_________(选填“一”或“二”)。你认为该方案更合理的依据是_______________(至少答出一条)。
(2)实验室中有一瓶未知浓度的硫酸铜溶液,为了测定其定量组成,小颖同学设计并进行了如图1所示的探究实验,图2为反应生成沉淀的质量与滴入氢氧化钠溶液质量的变化关系:
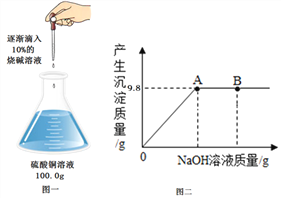
根据上述信息,请你回答下列问题:
①图2中B点对应溶液里所含的溶质为____________(填化学式)。
②试计算:该硫酸铜溶液的溶质质量分数是__________(计算结果精确到0.1%)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示的溶解度曲线图中,分别通过增加溶质、降低温度和温度不变的条件下蒸发溶剂这三种方法,均可使其不饱和溶液变为饱和溶液的是( )
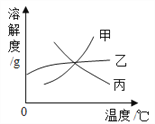
A. 溶液甲
B. 溶液丙
C. 甲和丙的混合溶液
D. 丙和乙的混合溶液
相关试题

