【题目】化学用语是学习化学的重要工具.
(1)写出下列对应的化学符号:
① 铝离子 ___________ ;② 硝酸分子 __________;③ 5个硅原子____________
④ 氦气 _________ ;⑤ 人体中最多的物质__________ ;⑥ 最简单的有机物______
(2)用下列字母序号填空:
a.硫酸铜 b.氯化钠 c.熟石灰 d.石墨
①_____________用作调味品和防腐剂;②_____________用作改良酸性土壤;
③_____________用配制波尔多液; ④_____________用作电极材料;
(3)写出下列反应的化学方程式:
① 湿法冶金:__________________________;
② 铝的自我保护__________________________;
③ 光合作用:__________________________;
④ 氢氧化钠在空气中变质:__________________________;该反应_____________复分解反应(填“属于”或“不属于”)
参考答案:
【答案】 Al3+ HNO3 5Si He H2O CH4 b c a d Fe+CuSO4=FeSO4+Cu 4Al + 3O2 = 2Al2O3 6CO2+6H2O=C6H1206+6O2 2NaOH+CO2===Na2CO3+H2O 不属于
【解析】(1)①离子符号书写:元素(或根)符号右上角的数字表示一个离子带电荷的数值,数字在左,正负号在右;铝离子Al3+ ;②化合物的化学式书写:显正价的元素其符号写在左边,显负价的写在右边,化合价的绝对值交叉约减,得化学式右下角的数字,数字为1时不写;硝酸分子 HNO3;③元素符号的书写:一个字母大写,两个字母第一个字母大写,第二个字母小写。元素符号的前边加数字表示原子的个数;5个硅原子5Si④ 氦气由原子直接构成,化学式为氦的元素符号He ;⑤ 人体中最多的物质是水H2O;⑥ 最简单的有机物是甲烷,化学式为CH4(2)①氯化钠常用作调味品和防腐剂;②熟石灰是碱能与酸反应生成盐和水,用作改良酸性土壤;③硫酸铜常用配制波尔多液; ④石墨有良好的导电性,用作电极材料;(3)① 常用铁与硫酸铜的反应进行湿法冶金,方程式为Fe+CuSO4=FeSO4+Cu ;② 常温下铝和氧气反应,生成致密的氧化铝薄膜,阻止铝的进一步氧化,反应方程式为:4Al + 3O2 = 2Al2O3;③ 光合作用是二氧化碳和水在光和叶绿素的作用下分解生成有机物和氧气,反应方程式为:6CO2+6H2O ![]() C6H1206+6O2 ;④ 氢氧化钠和空气中的二氧化碳反应生成碳酸钠和水而变质,反应方程式为:2NaOH+CO2===Na2CO3+H2O ;该反应不是两种化合物相互交换成分生成两种新的化合物的复分解反应。
C6H1206+6O2 ;④ 氢氧化钠和空气中的二氧化碳反应生成碳酸钠和水而变质,反应方程式为:2NaOH+CO2===Na2CO3+H2O ;该反应不是两种化合物相互交换成分生成两种新的化合物的复分解反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。则下列说法正确的是 ( )
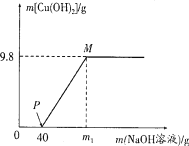
A. 整个反应过程中,溶液中氯离子个数不变
B. PM段的溶液中加入铁粉,会产生气泡
C. M点溶液中氯化钠的质量分数为8.3%
D. 沉淀完全时,m1的数值为80
-
科目: 来源: 题型:
查看答案和解析>>【题目】KCl和KNO3的溶解度表及溶解度曲线如下图所示,下列说法不正确的是 ( )

A. 甲表示KCl溶解度曲线
B. 两物质溶解度相等的温度t1在20℃~30℃
C. 40℃时,5gKCl加入10g水中,可得到33.3%的溶液
D. 50℃时,30g KNO3加入50g水,充分溶解,再降温到30℃,有晶体析出
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合图示实验装置,回答下列问题:

(1)图中a、b仪器的名称:a__________,b__________.
(2)某同学在实验室用C装置制取二氧化碳,反应的化学方程式为____________,C装置与B装置相比较,优点为__________________
(3)实验室用B装置制取氧气时,锥形瓶中应先加入试剂为__________.如要获得干燥的气体,除发生装置外,还应选用盛放__________(填写试剂名称)的D装置.如用E装置收集CO2,则气体应从______端通入(填“c”或“d”).
(4)实验室用熟石灰与硫酸铵共热制取氨气,应选_________发生装置,反应的化学方程式为__________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液)。主要生产流程如下:
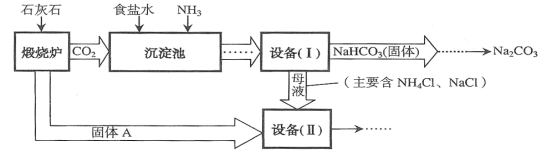
(已知2NH4Cl+Ca(OH)2==CaCl2+2NH3 ↑+2H2O)
(1)“煅烧炉”中发生反应的化学方程式是 。
(2)若在实验室里分离“设备(I)”中的混合物,用到的操作的名称是 。
(3)在“设备(Ⅱ)”中固体A与水反应的化学方程式是 。该反应属于 反应(填写基本反应类型)。
(4)对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有 (填写化学式)。
(5)请写出一个该生产流程的优点: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】锌是人体必需的的微量元素,称“生命元素”。
【锌的广泛应用】
(1)处于生长发育期的儿童、青少年如果缺锌,会导致发育不良,食欲差,反应迟钝。缺乏严重时,将会导致“_________ 症”和智力发育不良。 补“锌”采用药补与食补并举,经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”,这个“锌 ”指_____。
A. 单质 B. 元素 C. 原子 D. 分子
(2)实验室用锌与稀硫酸制取氢气,同时得到副产品硫酸锌。反应的化学方程式为___________________。
【制备七水硫酸锌】
以含锌废渣(主要成分为ZnO,杂质为FeO﹑CuO)为原料制备七水硫酸锌(ZnSO4·7H2O)的流程如下。

(1)粉碎的目的是___________________。
(2)若实验室用质量分数为98%,密度为1.84g/ml的浓硫酸配制200g、25%的稀硫酸,需要浓硫酸的体积为___________(精确到小数点后一位),配制时,需要的玻璃仪器有量筒﹑玻璃棒、烧杯和__________,
(3)物质X是__________,滤渣中含有的金属单质有__________,
(4)流程中获得七水硫酸锌前省略的操作是_______﹑冷却结晶﹑过滤、洗涤和低温烘干。
(5)某温度下,Fe(OH)3分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式__________。
(6)除铁过程中,温度、pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在__________℃为宜,pH应控制在__________为宜。
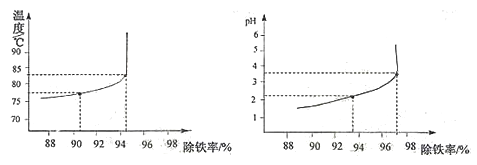
【组成测定】在一定条件下,向ZnSO4溶液中加入Na2CO3溶液,充分反应后,经过滤、洗涤、低温干燥得到纯净滤渣aZnCO3·bZn(OH)2·cH2O。为了确定aZnCO3·bZn(OH)2·cH2O组成,进行如下实验:
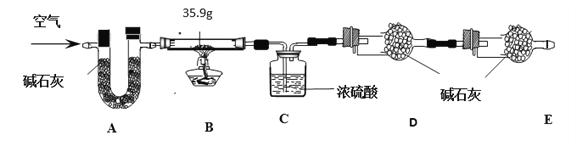
【查阅资料】(假设每步反应、吸收均完全。碱石灰为氢氧化钠和生石灰的混合物。)
aZnCO3·bZn(OH)2·cH2O受热分解生成ZnO、H2O、CO2三种产物,
其中ZnCO3
 ZnO+CO2↑;Zn(OH)2
ZnO+CO2↑;Zn(OH)2 ZnO+H2O。
ZnO+H2O。现称取35.9 g aZnCO3·bZn(OH)2·cH2O在B装置中进行煅烧,将完全煅烧过程中产生的气体依次通过装置C和装置D,它们分别增重7.2 g和4.4 g。
【实验分析及数据处理】
(1)装置A的作用是_______________。
(2)若没有E装置,测得二氧化碳的质量____________(填“偏大”、“偏小”或“无影响”)。
(3)根据上述数据,化学式a ZnCO3·b Zn(OH)2· c H2O中的a:b:c =_____________ 。
【反思与拓展】
滤渣成分因温度等不同导致a、b、c会有差异,假设B化学式为ZnCO3·2Zn(OH)2·H2O,向该B中加入稀硫酸,反应的化学方程式为:_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高安炒粉营养美味,下列用到的食材中富含蛋白质的是( )
A. 米粉 B. 青菜 C. 瘦猪肉 D. 花生油
相关试题

