【题目】据有关资料介绍:将贝壳(主要成分是碳酸钙)煅烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾。请写出煅烧贝壳的化学方程式:__________。
某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示。请你与小组同学共同完成以下探究:
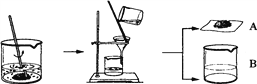
【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
实验内容 | 实验现象 | 实验结论 |
甲同学:取少量固体于试管中,向其中加入稀盐酸。 | _______。 | 自己的猜想正确 |
乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加_______ | 溶液由无色变为红色 | 自己的猜想正确 |
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是_________;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分。
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了______同学猜想正确,原因是__________________________________________。为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为___________________,小组同学通过相应的实验操作最终制得了氢氧化钾。
参考答案:
【答案】 CaCO3![]() CaO+CO2↑ 产生无色气体 无色酚酞溶液 乙同学的猜想也会有相同现象/加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2 丁 KOH为(可溶于水的)生成物一定有,而固体中有Ca(OH)2,说明溶液为Ca(OH)2的饱和溶液(或Ca(OH)2微溶于水),所以一定有Ca(OH)2 Ca(OH)2+K2CO3 ==CaCO3↓+ 2KOH
CaO+CO2↑ 产生无色气体 无色酚酞溶液 乙同学的猜想也会有相同现象/加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2 丁 KOH为(可溶于水的)生成物一定有,而固体中有Ca(OH)2,说明溶液为Ca(OH)2的饱和溶液(或Ca(OH)2微溶于水),所以一定有Ca(OH)2 Ca(OH)2+K2CO3 ==CaCO3↓+ 2KOH
【解析】(1).煅烧贝壳时,碳酸钙高温下分解生成二氧化碳、氧化钙,化学方程式:CaCO3高温CaO+CO2↑;(2).碳酸钙和稀盐酸反应生成二氧化碳, 产生无色气体说明有碳酸钙 (3). 氢氧化钙溶液能使酚酞试液变红; (4). 乙同学的猜想也会有相同现象/加入稀盐酸有气泡只能证明有CaCO3,不能证明有无Ca(OH)2 (5).化学反应结束后一定有的是生成物,可能有的是过量的反应物;碳酸钾和氢氧化钙反应生成碳酸钙沉淀和氢氧化钾,反应方程式为:Ca(OH)2+K2CO3 ==CaCO3↓+ 2KOH;所以一定有 KOH,而氢氧化钙微溶于水,当固体中有Ca(OH)2,溶液中一定是Ca(OH)2的饱和溶液(或Ca(OH)2微溶于水),所以一定有Ca(OH)2 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图象与所对应操作相符的是( )
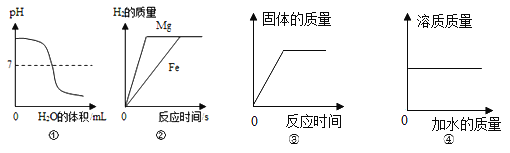
A. ①是对氢氧化钠溶液加水稀释
B. ②是将等质量镁片和铁片分别和等质量、等溶质质量分数的稀硫酸(足量)混合
C. ③向装有一定量铁粉的试管中滴加硫酸铜溶液
D. ④稀释氯化钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的装置图(固定装置省略),请回答下列问题:
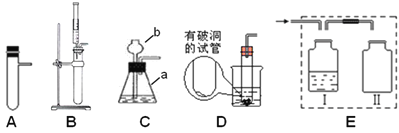
(1)仪器名称:a____________。
(2)B图的装置可用来制取氧气,写出制取该气体的化学方程式: ____________,
若用E收集一瓶干燥的氧气,其中Ⅰ瓶中盛放的试剂是________(填名称),并将图E补充完整___。
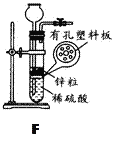
(3)实验室用锌粒与稀硫酸反应制取氢气,发生装置如F图所示。打开止水夹,若发现稀硫酸未能与有孔塑料板上锌粒接触,但此时已无稀硫酸可加,则下列溶液中,最适宜从长颈漏斗中添加的是_________(填字母)。
A.氢氧化钠溶液 B.碳酸钠溶液 C.硫酸钠溶液 D.澄清石灰水
(4)小明同学设计了如下图所示的实验装置,既可用于制取CO2,又可用于探究CO2的性质。
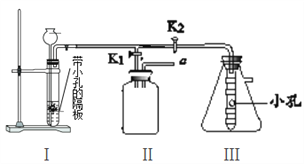
说明:①装置Ⅰ中盛放的药品是石灰石和稀盐酸。
②装置Ⅲ中在小试管外壁贴有4片试纸:其中两端的两片用紫色石蕊溶液润湿,中间两片用紫色石蕊溶液浸过并晒干。
a.实验时,打开K1关闭K2可用来制取CO2。装置Ⅰ中发生的化学反应的基本反应类型为__________,装置Ⅰ的优点是___________________________;若用排空气法收集CO2,请将图Ⅱ补充完整____;若在Ⅱ中放入_________,还可用于检验CO2。
b.实验时,关闭K1打开K2可用于探究CO2的性质。实验时Ⅲ中出现的现象是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学元素含量的多少对人体健康有着重要的影响。人体缺钙易引发的疾病是
A.贫血 B.夜盲症 C.骨质疏松 D.甲状腺肿大
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质间的转化不能一步完成的是
A.H2O→H2 B.Mg→MgO C.Na2CO3→NaOH D.KNO3→NaNO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是利用石灰石,食盐水,氨气进行工业生产纯碱的流程示意图(部分条件及物质未标出)。
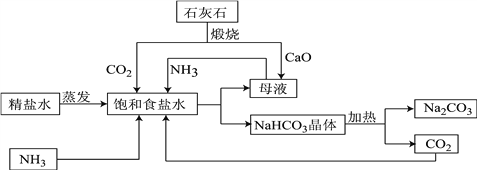
(1)粗盐精炼成精盐的过程中,要经过溶解、______、蒸发等操作,其中都必需用到的一种玻璃仪器为_______,
(2)图中母液含有一定量的NaHCO3,该溶液为该温度下NaHCO3的_________(填“饱和”或“不饱和”)溶液;
(3)流程中要通入CO2和NH3,应先通入NH3,理由是______________________________;精盐水经过氨化和二氧化碳酸化后生成碳酸氢钠和一种氮肥,请写出相应的化学方程式:_____。
(4)整个生产过程中可循环利用的物质为__________________(填化学式)。
(5)所得产品纯碱中含有少量碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(加热前固体的质量为m1,加热后为m2):_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示的是初中几种常见物质的转化关系(部分反应物、生成物及反应条件省略),已知C为生活中不可缺少的调味品,F为大理石的主要成分,D、E、H是同种类别的物质,请回答以下问题:
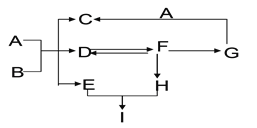
(1)写出下列物质的化学式:F_______________。
(2)写出物质B的一种用途________________。
(3)写出G和A的溶液反应的实验现象_________________,
其反应的化学方程式为_________________________________。
(4)上述反应中除了D和F可以相互转化外,还有哪些物质之间也可以相互转化:_____。
(5)A~I这9种物质没有涉及到物质类别中的________填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
相关试题

