【题目】如图是利用石灰石,食盐水,氨气进行工业生产纯碱的流程示意图(部分条件及物质未标出)。
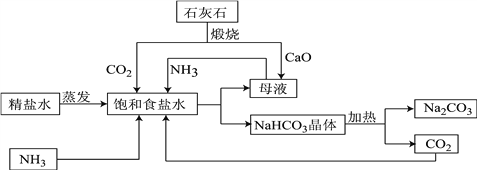
(1)粗盐精炼成精盐的过程中,要经过溶解、______、蒸发等操作,其中都必需用到的一种玻璃仪器为_______,
(2)图中母液含有一定量的NaHCO3,该溶液为该温度下NaHCO3的_________(填“饱和”或“不饱和”)溶液;
(3)流程中要通入CO2和NH3,应先通入NH3,理由是______________________________;精盐水经过氨化和二氧化碳酸化后生成碳酸氢钠和一种氮肥,请写出相应的化学方程式:_____。
(4)整个生产过程中可循环利用的物质为__________________(填化学式)。
(5)所得产品纯碱中含有少量碳酸氢钠,如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为(加热前固体的质量为m1,加热后为m2):_______。
参考答案:
【答案】 过滤 玻璃棒 饱和 使溶液呈碱性,促进CO2的吸收 NaCl+H2O+CO2+NH3===NaHCO3+NH4Cl NH3、CO2 ![]()
【解析】(1)粗盐精炼成精盐的过程中,要经过溶解、过滤、蒸发等操作除掉其中的难溶性固体杂质,其中都必需用到的一种玻璃仪器为玻璃棒,溶解时玻璃棒的作用是:搅拌加速溶解;过滤时:引流;蒸发时:搅拌使液体受热均匀,防止液体局部沸腾飞溅。(2)析出晶体后的溶液一定是饱和溶液,该溶液为该温度下NaHCO3的饱和溶液;(3)流程中要通入CO2和NH3,应先通入NH3,理由是形成碱性溶液,游离二氧化碳的吸收;精盐水经过氨化和二氧化碳酸化后生成碳酸氢钠和一种氮肥,相应的化学方程式:NaCl+H2O+CO2+NH3===NaHCO3+NH4Cl。(4)整个生产过程中可循环利用的物质为二氧化碳、氨气。(5)碳酸氢钠加热条件生抽碳酸钠、二氧化碳、水,所以加入后所得固体就是碳酸钠;
2NaHCO3![]() Na2CO3+H2O+CO2↑ m
Na2CO3+H2O+CO2↑ m
168 106 62
m1 m1-m2
168/ m1=62/ m1-m2
纯碱中碳酸氢钠的质量分数可表示为![]()
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学元素含量的多少对人体健康有着重要的影响。人体缺钙易引发的疾病是
A.贫血 B.夜盲症 C.骨质疏松 D.甲状腺肿大
-
科目: 来源: 题型:
查看答案和解析>>【题目】据有关资料介绍:将贝壳(主要成分是碳酸钙)煅烧后与草木灰(主要成分是碳酸钾)在水中作用,可以得到氢氧化钾。请写出煅烧贝壳的化学方程式:__________。
某化学课外小组的同学们为了制取氢氧化钾,将少量碳酸钙充分灼烧后的固体放入烧杯中,再向其中加入一定量10%的碳酸钾溶液,充分反应冷却后过滤、洗涤得到固体A和溶液B,操作步骤如图所示。请你与小组同学共同完成以下探究:
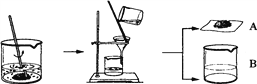
【提出问题1】固体A中的成分是什么?
【猜想与假设】甲同学:只有CaCO3 乙同学:CaCO3、Ca(OH)2
【实验与探究】甲、乙同学为了验证各自的猜想,分别进行了实验:
实验内容
实验现象
实验结论
甲同学:取少量固体于试管中,向其中加入稀盐酸。
_______。
自己的猜想正确
乙同学:取少量固体于试管中,加水充分溶解、过滤,向滤液中滴加_______
溶液由无色变为红色
自己的猜想正确
【反思与评价】小组同学讨论后认为,甲同学的实验不能证明他的猜想,理由是_________;而乙同学的实验能证明他的猜想,因此小组同学确定了固体A的成分。
【提出问题2】溶液B中溶质的成分是什么?
【猜想与假设】丙同学:KOH、K2CO3 丁同学:KOH、Ca(OH)2
【表达与交流】结合对固体成分的探究,同学们经过讨论确定了______同学猜想正确,原因是__________________________________________。为了得到纯净的氢氧化钾,需要向溶液B中滴加适量的一种溶液,发生反应的化学方程式为___________________,小组同学通过相应的实验操作最终制得了氢氧化钾。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质间的转化不能一步完成的是
A.H2O→H2 B.Mg→MgO C.Na2CO3→NaOH D.KNO3→NaNO3
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图表示的是初中几种常见物质的转化关系(部分反应物、生成物及反应条件省略),已知C为生活中不可缺少的调味品,F为大理石的主要成分,D、E、H是同种类别的物质,请回答以下问题:
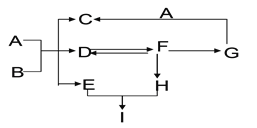
(1)写出下列物质的化学式:F_______________。
(2)写出物质B的一种用途________________。
(3)写出G和A的溶液反应的实验现象_________________,
其反应的化学方程式为_________________________________。
(4)上述反应中除了D和F可以相互转化外,还有哪些物质之间也可以相互转化:_____。
(5)A~I这9种物质没有涉及到物质类别中的________填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】今年“地球一小时”活动的主题是“蓝色WE来”,旨在引导人们从细微之处践行环保理念。下列做法不符合这一环保主题的是
A.自带布袋购物 B.草稿纸尽可能两面使用
C.使用一次性木筷 D.选择自行车作为出行工具
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
选项
物质
除杂试剂(足量)
操作方法
A
CO(CO2)
氢氧化钠溶液
气体通过盛有氢氧化钠溶液的洗气瓶
B
K2CO3(KCl)
稀盐酸
加入稀盐酸、蒸发、结晶
C
FeSO4(CuSO4)
锌粉
加入锌粉并过滤
D
Zn(Fe)
稀硫酸
加入稀硫酸,过滤
A. A B. B C. C D. D
相关试题

