【题目】今有铜、锌混合物20g,该混合物恰好与200g稀盐酸中完全反应,生成0.4g氢气。试回答:
(1)铜、锌混合物中金属锌的质量为多少_______?
(2)该稀盐酸中溶质的质量分数为多少_______?(精确到0.1%)
(3)反应后溶液中溶质的质量分数为多少_______?(精确到0.1%)
参考答案:
【答案】13g 7.3% 12.8%
【解析】
根据生成的氢气的质量和对应的化学方程式求算锌的质量以及氯化锌的质量和该稀盐酸中溶质的质量分数,进而求算所得溶液中氯化锌的质量分数。
解:设锌的质量为x,生成的氯化锌的质量为y,该稀盐酸中溶质的质量分数为z,

![]() x=13g,
x=13g,
![]() y=27.2g,
y=27.2g,
![]() z=7.3%,
z=7.3%,
反应后溶液中溶质的质量分数为![]() ×100%≈12.8%;
×100%≈12.8%;
答:(1)铜、锌混合物中金属锌的质量为13g;
(2)该稀盐酸中溶质的质量分数为7.3%;
(3)反应后溶液中溶质的质量分数为12.8%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铁在日常生活中有着重要作用。请回答:
(1)铁生锈实际上是铁与空气中的氧气和______(填名称)发生反应的结果,生活中可以采用______(写一种方法即可)的方法防止铁制品生锈。
(2)铁在高温下与水蒸气反应生成四氧化三铁和氢气。该反应的化学方程式为:______,该反应属于______反应(填基本反应类型)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙、丙是仅由碳、氧两种元素组成的单质或化合物,其中丁由钙、氧和碳三种元素组成。它们之间的转化关系如图所示(图中部分反应物、生成物及反应条件已略去)。
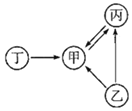
(1)写出下列物质的化学式:甲______、丙______。
(2)实验室制取甲的化学方程式______。
(3)写出甲与澄清石灰水发生反应的化学方程式______。
(4)由甲转化为丙的化学方程式______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A-G都是初中化学常见的物质。已知A和G均为黑色固体,C为红色固体单质,B、E、F为无色气体,D为无色液体。它们的转化关系如图所示(部分条件略去)。
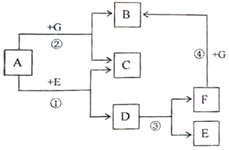
(1)写出A、B、E的化学式A:______,B:______,E:______。
(2)反应①的化学方程式为:______。
(3)反应②的化学方程式为:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语表达错误的是( )
A. 五个氢原子:H5 B. 氯原子结构示意图:
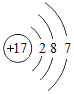
C. 两个钙离子:2Ca2+ D. 三个水分子:3H2O
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下列实验装置图,回答问题:

(1)写出图中标有序号的仪器名称:①_______;②________。
(2)实验室用A、E装置组合制取氧气的反应方程式是________。实验结束时应先__________ 再___________(选“移出导管”和“熄灭酒精灯”)。
(3)实验室用过氧化氢溶液和二氧化锰制取氧气时,选用的气体发生装置是_____(填装置序号,下同),收集装置可选_____,组装好仪器后,应先________,再添加药品;该反应化学方程式为:____________。
(4)实验改进:查阅资料发现,氧化铜可以用作过氧化氢分解制氧气的催化剂,小明同学将一根洁净铜丝的一端绕成螺旋状,再经过_____处理,设计了如图F所示的发生装置(已略去夹持装置),该装置的优点是_____________________。
(5)甲烷是天然气的主要成分,实验室用加热醋酸钠和碱石灰的固体混合物的方法制取甲烷,则实验室制取并收集甲烷应选择的装置组合是_____。(填字母)
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲烷燃烧时发生的化学反应的微观示意图如图所示。其中,
 表示碳原子,
表示碳原子, 表示氧原子,
表示氧原子, 表示氢原子。(提示:CH4 + 2O2
表示氢原子。(提示:CH4 + 2O2 CO2 + 2H2O)
CO2 + 2H2O)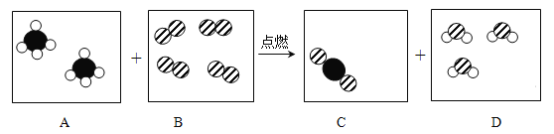
(1)请在上图中补画微观粒子图示。____________
(2)上述变化过程中,不能再分的粒子是____________(填一粒子名称)。
(3)写出甲烷燃烧实验中生成物水的检验方法____________________________________。
相关试题

