【题目】硫酸锌溶液可以作木材防腐剂。工业上常用红锌矿(主要含ZnO)和18~25%稀硫酸为原料制取硫酸锌,化学反应方程式:H2SO4 + ZnO ZnSO4 + H2O。
(1)硫酸锌中硫元素和氧元素的质量比是 。
(2)100 g溶质质量分数为98%的浓硫酸配制成20%的稀硫酸。加入水的质量是 g。
(3)取50 kg某红锌矿与足量稀硫酸充分反应,最后得到80.5 kg硫酸锌,则红锌矿中氧化锌的质量分数是多少?(假设红锌矿中的杂质不与稀硫酸反应)
参考答案:
【答案】(1)1 : 2(2)390 (3)81%
【解析】
试题分析: (1)ZnSO4中硫元素和氧元素的质量比为32:(16×4)=1:2
(2)解:需要加水的质量为X
100g×98%=(100g+x)×20% x=390g
(3)解:设:氧化锌的质量为x。
H2SO4 + ZnO![]() ZnSO4 + H2O
ZnSO4 + H2O
81 161
x 80.5 kg
![]()
x=40.5 kg
红锌矿中氧化锌的质量分数=![]() ×100% = 81%
×100% = 81%
答:红锌矿中氧化锌的质量分数为81% 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】阅读下面科普短文。
随着环境意识的提高,人们对室内空气质量越来越关心。下表列举了室内空气的主要污染物及来源。
污染源
污染物
建筑材料
NH3、甲醛(CH2O)、苯(C6H6)、甲苯(C7H8)、石棉纤维等
家具
甲醛(CH2O)、甲苯(C7H8)等
办公用品
O3、电磁辐射等
烹饪
CO、NO2、SO3、PM10等
室内微生物
结核杆菌、霉菌等
从上表看出室内污染物种类繁多,其中室内甲醛污染已被列入对公众健康影响最大的环境因素之一。室内空气中的甲醛主要来自于人造板材料制作的家具、地板以及胶黏剂等。这些材料用的越多,甲醛在室内空气中的浓度越高。甲醛的释放期非常长,人们打开人造板家具柜门时,闻到的刺激性气味主要是甲醛的气味。改善室内空气质量的方法有很多。通常情况下,开窗通风是改善室内空气质量最有效的方法。运用功能性装饰材料也可以改善室内空气质量。研究表明硅藻泥也可以净化空气。硅藻泥的主要成分是硅藻土,是由水生浮游类生物沉积而成。电子显微镜显示,硅藻土粒子表面具有无数微小的孔穴,功能与活性炭相似。正是这种多孔的结构,使硅藻泥成为具有净化空气功能的内墙装饰材料。
“光触媒技术”是20世纪70年代发展起来的一门新兴技术。“光触媒”是一种纳米级材料,具有强烈的催化分解功能。图一就是“光触媒”技术应用于分解甲醛、氨气、甲苯等有害物质的原理图。
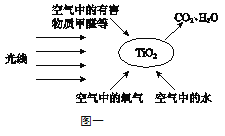
空气净化器是净化室内空气的重要设备。图二是某品牌空气净化器的净化效果图,其中a、b、c是甲醛随开机时间浓度变化的三条曲线。

为满足人们对健康住宅的需求,提高人们的生活质量,使生活由舒适型向健康型方向发展,人们
正在不断优化新的技术。
依据短文内容,回答下列问题:
(1)甲醛(CH2O)属于 (填“无机物”或“有机物”)。
(2)一氧化碳的污染源是 。
(3)下列说法正确的是 (填序号)。
a.甲醛易挥发
b.硅藻泥通过吸附污染物净化了空气
c.吸收、转化、降低室内污染物的浓度都可以改善室内空气质量
(4)“光触媒技术”可将污染物转化为水和二氧化碳,依据图一写出该反应的条件: 。
(5)依据图二提出一条使用空气净化器的建议: 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊。甲组同学进行右图所示的实验,却未观察到预期现象。

【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】
①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。
②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。经讨论,同学们认为猜想①不合理,其理由是 。
【进行实验】乙组同学针对猜想②进行实验。
实验目的
实验操作
实验现象
探究猜想②
取4支试管,向其中分别加入
碳酸钠溶液浓度/%
是否浑浊
10
不浑浊
5
不浑浊
1
浑浊
0.5
浑浊
【解释与结论】
(1)补全上述实验操作:取4支试管,向其中分别加入 。
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是 。
(3)乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5~10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是 。
【实验反思】
(1)丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:

丙组同学的实验目的是 。
(2)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊。其实验操作是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学实验操作中常常有许多“先后”之分,否则就会出现事故或者使实验失败。下列实验操作的先后顺序正确的是
A.检查装置气密性时,先用手紧捂试管,后将导管伸入水中
B.用滴管吸取液体时,先在空气中挤捏胶帽排出空气,后伸入液体中吸取
C.实验室制取二氧化碳时,先加稀盐酸,后加石灰石
D.排水法收集氧气,先熄灭酒精灯,后移出导气管
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关空气及其成分的说法正确的是
A.空气中二氧化碳质量分数为0.03%
B.鱼能在水中生存,说明氧气易溶于水
C.空气中可吸入颗粒物的多少不会影响人体健康
D.稀有气体在通电时能发出不同颜色的光,可用作电光源
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物品所使用的主要材料属于合成材料的是
A. 玻璃水杯 B. 不锈钢餐具 C. 塑料薄膜 D. 羊毛绒衣
-
科目: 来源: 题型:
查看答案和解析>>【题目】用:H2O,H2SO4,CaO,Cu(OH)2,Fe写出符合要求的化学方程式.
(1)化合反应 (2)分解反应
(3)置换反应 (4)复分解反应
相关试题

