【题目】某固体粉末由Mg、MgO、Mg (OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图11所示的装置(固定装置省略)。已知本实验条件下,氢气密度为0.09g/L。
【实验过程】
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测得生成气体的体积为55.6mL。
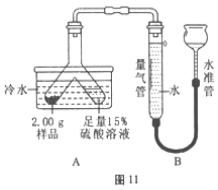
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
【回答问题】
(1)使样品与硫酸充分反应的正确操作是_________(填标号)。
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
(2)判断样品完全反应的现象是___________________________。
(3)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是______________。
②通过步骤Ⅲ计算,样品中镁元素的总质量为______________。
③结论:该样品中的成分是______________________________。
参考答案:
【答案】 A Y形管中的固体全部消失 Mg 1.20 Mg、MgO和Mg (OH)2
【解析】(1)为了防止固体药品粘在容器壁上,可将液态的硫酸溶液转移到样品中;故填:A;
(2)镁、氧化镁和氢氧化镁均能与稀硫酸反应,所以看到固体药品完全消失了,就证明样品已完全反应;
(3)①镁与稀硫酸反应生成硫酸镁和氢气,而氧化镁、氢氧化镁与稀硫酸反应均没有气体生成,由实验现象可知,样品中一定含有镁;
氢氧化镁沉淀中镁元素的质量即为样品中镁元素的质量,即2.90g×![]() ×100%=1.20g;
×100%=1.20g;
②设生成55.6mL氢气需要镁的质量为x
Mg+H2SO4=MgSO4+H2↑
24 2
x0.0556L×0.09g/L
![]()
x=0.06g
若剩余固体全部为氧化镁,则含镁元素的质量为:(2.00g-0.06g)×![]() ×100%=1.164g≠(1.20g-0.06)=1.14g
×100%=1.164g≠(1.20g-0.06)=1.14g
所以固体样品是由镁、氧化镁和氢氧化镁三种物质组成的;故填:Mg、MgO和Mg(OH)2。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化工厂用废硫酸制备K2SO4的流程如下:

(1)生产上将CaCO3研成粉末的目的是______________。
(2)上述流程中,除可综合利用CO2外,还可循环使用的物质是_____________(填写化学式)。
(3)反应③中相关物质的溶解度如下表所示。反应③在常温下能实现的原因是______________________。
(4)洗涤反应③所得晶体不用水而用饱和K2SO4溶液的目的是_____________________;
检验此晶体是否洗涤干净的方法是_____________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】走进“化学村”。 “化学村”的布局如下:
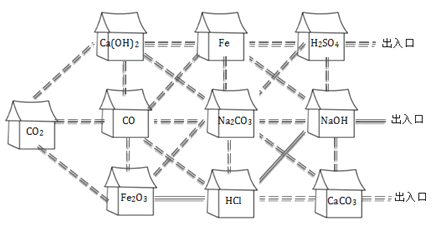
(1)认识“居民”。
①10户“居民”中,俗称熟石灰的是________,属于氧化物的有___________。
②“居民”CO与Fe2O3反应的化学方程式为_____________________
③盐酸有5户相邻的“居民”:Fe2O3、CO、Na2CO3、NaOH、CaCO3,其中不能与它发生反应的是____________
(2)认识“村中的路”。只有相邻且能相互反应的“居民”间才是通路。例如,上图中涂成黑色实线的是一条从“Fe2O3家”到达出入口的路。请你在图中涂出一条从“CO2家”到达任一出入口的路。_________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】请选择与下列叙述相对应物质的序号填空:
①黄铜;②活性炭;③铁;④二氧化碳;⑤青铜;⑥氧气;⑦生铁;⑧钢
(1)可用于灭火的气体是_________;(2)可用于消除水中异味的是_____________;(3)人类历史上使用最早的金属材料是_________; (4)工业上以高炉为主要设备制得的主要产品是_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是KNO3和NaCl的溶解度曲线。下列说法中正确的是 ( )
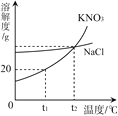
A. NaCl的溶解度大于KNO3的溶解度
B. 在温度高于t2℃时,100gKNO3饱和溶液中溶质的质量大于100g NaCl饱和溶液中溶质的质量
C. t1℃时,KNO3饱和溶液中溶质的质量分数是20%
D. t2℃时的NaCl溶液与KNO3溶液中,溶质的质量分数相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】某集气瓶里盛有空气,欲除去其中的氧气而得到较纯净的氮气时,最好采用的物质是
A. 蜡烛 B. 木炭 C. 红磷 D. 硫粉
-
科目: 来源: 题型:
查看答案和解析>>【题目】我们每时每刻都离不开空气。空气中含量最多的气体是( )
A. N2 B. CO2 C. H2 D. O2
相关试题

