【题目】我们每时每刻都离不开空气。空气中含量最多的气体是( )
A. N2 B. CO2 C. H2 D. O2
参考答案:
【答案】A
【解析】试题分析:空气中成分及含量分别是:78%的氮气,21%的氧气,0.94%的稀有气体和0.03%的二氧化碳,所以空气中含量最多的是氮气,选项A正确。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某固体粉末由Mg、MgO、Mg (OH)2中的一种或几种组成。某化学小组为了探究该固体粉末的成分,设计如图11所示的装置(固定装置省略)。已知本实验条件下,氢气密度为0.09g/L。
【实验过程】
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测得生成气体的体积为55.6mL。
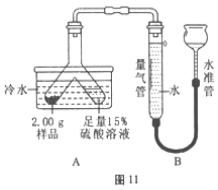
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
【回答问题】
(1)使样品与硫酸充分反应的正确操作是_________(填标号)。
A.硫酸溶液转移到样品中 B.样品转移到硫酸溶液中
(2)判断样品完全反应的现象是___________________________。
(3)根据实验结果分析:
①通过步骤Ⅱ推断,样品中一定含有的物质是______________。
②通过步骤Ⅲ计算,样品中镁元素的总质量为______________。
③结论:该样品中的成分是______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是KNO3和NaCl的溶解度曲线。下列说法中正确的是 ( )
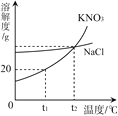
A. NaCl的溶解度大于KNO3的溶解度
B. 在温度高于t2℃时,100gKNO3饱和溶液中溶质的质量大于100g NaCl饱和溶液中溶质的质量
C. t1℃时,KNO3饱和溶液中溶质的质量分数是20%
D. t2℃时的NaCl溶液与KNO3溶液中,溶质的质量分数相等
-
科目: 来源: 题型:
查看答案和解析>>【题目】某集气瓶里盛有空气,欲除去其中的氧气而得到较纯净的氮气时,最好采用的物质是
A. 蜡烛 B. 木炭 C. 红磷 D. 硫粉
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列仪器,可在酒精灯火焰上直接加热的是
A. 漏斗 B. 烧杯 C. 量筒 D. 试管
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学兴趣小组的同学做中和反应实验时,将稀盐酸滴入氢氧化钠溶液中,看到有气泡产生,是不是拿错了药品?经检验确认没有拿错药品,而是氢氧化钠溶液变质了。
【分析】氢氧化钠变质的原因是_______________________________________(用化学方程式表示)。
【提出问题1】该氢氧化钠溶液是全部变质还是部分变质?
【查阅资料】①已知反应:BaCl2+Na2CO3==2NaCl+BaCO3↓(白色)
②氯化钡溶液呈中性。
【设计实验】依据查阅的资料设计实验步骤,并进行实验,根据实验现象推断相应实验结论。
实验步骤
实验现象
实验结论
(1)取少量该溶液于试管中,向溶液中滴加过量氯化钡溶液,并不断振荡。
有白色沉淀产生。
说明原溶液中一定含有
_____________。
(2)取(1)试管中的上层清液滴加酚酞试液。
溶液变红色。
则溶液中一定含有__________。
【实验结论】同学得出的结论是:氢氧化钠溶液_______________变质(填“部分”或“全部”)。
【进一步实验】该小组同学用变质的溶液制取不含杂质的氢氧化钠溶液,继续完成中和反应实验。请你帮助他们解决下列问题:
(1)除去氢氧化钠溶液中存在的上述杂质可加入适量的______________________。
(2)借助于_____________________可判断盐酸和氢氧化钠溶液恰好完全反应。
[提出问题2]该溶液的变质程度如何呢?
实验步骤:取该溶液50克,逐滴加入质量分数为7.3%的稀盐酸至无气泡冒出为止,所加盐酸质量与产生气体质量关系如图:

试计算:生成气体m的值_________________(请写出解题过程)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化中,属于化学变化的是( )
A. 干冰升华 B. 食物腐败
C. 活性炭吸附色素 D. 矿石粉碎
相关试题

