【题目】某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了如图所示的实验方案:

(1)试管乙反应的化学方程式为:_________;
(2)同学们经讨论后认为该方案可以优化,_________试管的实验是多余的。同学们通过实验探究得出三种金属的活动性由强到弱的顺序为_________________________。
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,得到不溶物和滤液,并对不溶物的成分进行如下探究:
【提出问题】烧杯中不溶物的成分是什么?
【实验探究】向过滤得到的不溶物中加_____________________。
①若无气泡产生,则不溶物的成分是________________________。
②若有气泡产生,则不溶物中一定含有______________________。
参考答案:
【答案】 Fe+CuSO4=FeSO4+Cu 丙 镁>铁>铜 稀盐酸或稀硫酸 铜 铜、铁
【解析】本题主要考查金属活动性的探究;书写化学方程式。试管乙中铁与硫酸铜溶液反应生成铜和硫酸盐铁溶液,现象是溶液有蓝色变为浅绿色,生成红色固体;甲、乙就可以证明三种金属的活动性强弱,故丙是多余的;①向过滤得到的不溶物中加稀硫酸,无气泡产生,根据金属能否与酸反应解答;②向过滤得到的不溶物中加稀硫酸,有气泡产生,根据金属能否与酸反应解答。
(1)试管乙中铁与硫酸铜溶液反应生成铜和硫酸盐铁溶液,反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
(2)甲、乙就可以证明三种金属的活动性强弱Mg>Fe>Cu,故丙是多余的;
(3)向过滤得到的不溶物中加稀硫酸,①无气泡产生,说明不溶物中没有镁和铁,故不溶物的成分是铜;
②有气泡产生,若镁过量,则铜盐和铁盐均被置换出来,不溶物中含有镁、铁、铜,若镁少量,则不溶物中一定含有铁和铜,因此不溶物中一定含有铁和铜,
-
科目: 来源: 题型:
查看答案和解析>>【题目】地壳中含量最多的元素是
A. 铝元素 B. 氧元素 C. 硅元素 D. 铁元素
-
科目: 来源: 题型:
查看答案和解析>>【题目】构建知识网络是学习化学的一种重要方法。下图是某同学绘制的以稀盐酸为例的酸的化学性质网络示意图,其中X与图中所给物质的类别不同。结合此图回答下列问题:
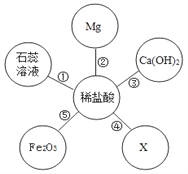
(1)反应①中石蕊溶液变为_________色;
(2)写出反应②和⑤的化学方程式:______________;______________.
(3)若X溶液既能跟稀盐酸反应,又能跟Ca(OH)2反应,则X可能是(写化学式):____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】生活离不开水。净化水的知识在日常生活中有着广泛的应用。
(1)茶杯内的纱网可将茶叶与茶水分离,便于饮用,该设计利用的化学原理是_______。
(2)自制净水器中常加入___________除去水中的异味和色素。
(3)井水中含有较多的钙、镁离子,为降低硬度,生活中采用的方法是____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金刚石和石墨物理性质差异很大的原因____________________
CO和CO2性质不同的原因____________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】生铁和钢都是铁合金,生铁中碳的含量在2.0% -4.3%之间,钢中碳的含量在0.03% -2%之间。某兴趣小组同学取铁合金样品5.7g(假设只含铁单质及碳单质),加入稀硫酸至不再产生气体为止,反应过程中生成的气体与所加稀硫酸的质量关系如图所示。
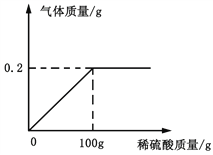
根据计算回答(计算结果保留一位小数):
(1)该铁合金是生铁还是钢?
(2)加入的稀硫酸中溶质的质量分数是多少?
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关物质的鉴别方案错误的是
A. 用点燃的方法鉴别棉布和羊毛 B. 用闻气味的方法鉴别白酒和白醋
C. 用BaCl2溶液鉴别碳酸钠和硫酸钠溶液 D. 用澄清石灰水鉴别氮气和二氧化碳
相关试题

