【题目】在化学课上,老师带来一瓶未知溶液A,已知它是稀盐酸或稀硫酸中的一种。进行如下实验:
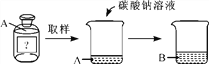
观察到烧杯中的现象是____________。
【提出问题】A是哪一种酸?
老师要求甲、乙同学从反应后的溶液B分别展开探究。
【猜想假设】甲同学:A是稀盐酸;乙同学:A是稀硫酸。
【实验探究】
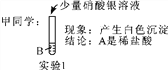
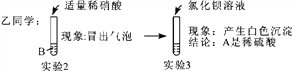
【评价交流】甲同学的实验________(填“能”或“不能”)得出正确结论,乙同学的实验________(填“能”或“不能”)得出正确结论。
实验3发生反应的化学方程式为______________________________________;反应后所得溶液中一定含有的离子是__________________________。
参考答案:
【答案】 产生气泡 不能 能 BaCl2+ Na2SO4===BaSO4↓+2NaCl 钠离子、硝酸根离子、氯离子
【解析】(1). 盐酸】硫酸都能与碳酸钠反应生成二氧化碳产生气泡 , 溶液是稀盐酸或稀硫酸中的一种,烧杯中的现象是产生气泡; (2). 加入硝酸银后产生白色沉淀不能 证明溶液就是盐酸,因为碳酸钠也能与硝酸银反应生成生白色沉淀; (3). 先加入适量硝酸,将碳酸钠转化成硝酸钠,然后再加入氯化钡,如果原溶液是硫酸,则溶液中有硫酸钠,而生成硫酸钡白色沉淀,如是原溶液是盐酸则不反应无明显现象; (4). 氯化钡和硫酸钠反应生成硫酸钡和氯化钠,反应方程式为:BaCl2+ Na2SO4===BaSO4↓+2NaCl; (5).因反应生成氯化钠,所以溶液中一定有钠离子、氯离子,还有加入硝酸引入的、硝酸根离子。
-
科目: 来源: 题型:
查看答案和解析>>【题目】把质量相同的浓盐酸和浓硫酸,分别敞口置于天平的左右盘上,一段时间后指针
A. 指向左边 B. 指向右边 C. 仍然平衡 D. 无法判断
-
科目: 来源: 题型:
查看答案和解析>>【题目】氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO2与NaOH能够发生反应,某同学按右图组装实验装置,并进行实验。
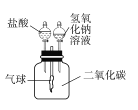
(1)有时药品滴加顺序会影响实验现象。如果观察到的现象是“气球先膨胀,后变瘪”,则加入试剂的顺序应该是________(填序号)
A.先加入盐酸,再加入氢氧化钠溶液 B.先加入氢氧化钠溶液,再加入盐酸
(2)请解释气球“先膨胀”的原因:______________。
(3)写出气球“后变瘪”的化学方程式________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小明从小都只习惯吃米饭、吃肉和油炸食品,此外还喜欢喝牛奶,但却不喜欢吃蔬菜,也不习惯吃水果。那么根据你所学的知识判断,小明的饮食习惯中,容易导致哪种营养素缺失
A.油脂 B.维生素 C.蛋白质 D.糖类
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列有关对一些现象的解释,不正确的是
A.湿衣服在阳光下比在阴凉处干得快是因为温度越高分子运动速率越快
B.物质具有热胀冷缩现象是因为分子或原子的大小可随温度的变化而变化
C.糖是甜的,醋是酸的是因为不同的物质分子具有不同的性质
D.水通电后可以产生氢气和氧气说明分子在化学反应中还可以再分 -
科目: 来源: 题型:
查看答案和解析>>【题目】甲同学为了区别氢氧化钠和氢氧化钙溶液,设计了如下图所示的四组实验方案。
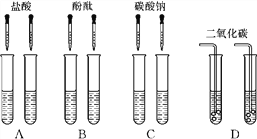
(1)其中能达到实验目的的是________。
(2)在C组实验中发生反应的化学方程式为______________________________________。
(3)实验结束后,甲同学将A、C组四支试管中的溶液倒入同一容器中,看到溶液变浑浊,该现象说明有________(填化学式)生成,滴入酚酞后溶液呈红色。
(4)滴入酚酞后溶液呈红色,说明溶液呈碱性。使溶液呈碱性的物质是什么呢?甲同学进一步推测:溶液中呈碱性的物质可能是碳酸钠、氢氧化钙和________三种物质中的一种,或是三种物质两两混合组成的混合物。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图所示(已知甲、乙、丙在生成物中化合价均为+2价).则下列说法中不正确的是( )

A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
相关试题

