【题目】根据表中信息,请回答下列问题:
部分碱、酸、盐的溶解性表(20℃)
阴离子 阳离子 | OH- | NO3- | Cl- | SO42- | CO32- | PO43- |
H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | 溶 | |
K+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶 |
Na+ | 溶 | 溶 | 溶 | 溶 | 溶 | 溶溶 |
Ba2+ | 溶 | 溶 | 溶 | 不 | 不 | 不 |
Ca2+ | 微 | 溶 | 溶 | 微 | 不 | 不 |
Cu2+ | 不 | 溶 | 溶 | 溶 | — | 不 |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“徽”表示微溶于水,“挥”表示挥发性,“—”表示那种物质不存在或遇到水就分解了。
(1)CaCO3属于______(填“可溶物”、”徽溶物”或“不溶物”)。
(2)表中可溶于水的硫酸盐有__种。
(3)在溶液中,磷酸钠与氯化钙能否发生复分解反应。若能,写出化学方程式;若不能,说明理由。______
(4)某同学将盐酸倒入Ba(OH)2溶液中,得到溶液甲。
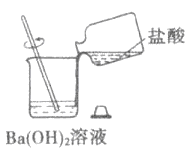
① 溶液甲中溶质的组成情况可能有______种。
② 实验设计:探究溶液甲中可能含有的溶质
a.探究溶液甲中是否含盐酸
方案编号 | 实验操作 | 实验现象 |
1 | 取少量溶液甲于试管中,加入铁粉 | 是否_________ |
b.探究溶液甲中是否含Ba(OH)2
方案编号 | 实验操作 | 实验现象 |
2 | 取少量溶液甲于试管中,加入_______溶液 | 是否产生蓝色沉淀 |
3 | 取少量溶液甲于试管中,加入Na2SO4溶液 | 是否产生白色沉淀 |
上述三个方案中有一个不合理,请指出不合理的方案编号并说明理由:__________。
③ 欲从溶液甲中获得纯净的日BaCl2固体,应采取的简单操作是_________。
参考答案:
【答案】(1)不溶物;(2)3;(3)2Na3PO4+3CaC12=Ca3(PO4)2↓+6NaCl
(4)①3;② a.有气泡产生;b. Cu(NO3)2(或CuCl2,其他合理答案均可)3,溶液中含有BaCl2,不论是否含有Ba(OH)2均会产生白色沉淀(其他合理答案均可)
③ 测溶液甲的pH,若pH ≤7,蒸发结晶;若pH > 7,向溶液甲中加入盐酸至溶液pH ≤7,再蒸发结晶。(其他合理答案均可)
【解析】(1)由题中信息可知碳酸钙属于不溶物;(2)由金属或铵根和酸根组成的化合物叫盐,表中可溶于水的硫酸盐有硫酸钠、硫酸钾、硫酸铜三种;(3)由两种化合物相互交换成分形成两种新的化合物的反应叫复分解反应。复分解反应的条件是生成沉淀或气体或水;磷酸钠与氯化钙能发生复分解反应,反应方程式为:2Na3PO4+3CaC12=Ca3(PO4)2↓+6NaCl;(4)①氢氧化钡和盐酸反应时,所得溶液中的溶质有三种可能:刚好完全反应时:只有氯化钡;碱过量时为:氯化钡、氢氧化钡;酸过量时:氯化钡和氯化氢;② a.铁能与盐酸反应生成氯化亚铁和氢气,取少量溶液甲于试管中,加入铁粉 观察是否有气泡产生,可以验证是否有氯化氢;b. Cu(NO3)2(或CuCl2)等含有铜离子的盐溶液能与氢氧化钡反应生成氢氧化铜蓝色沉淀,所以可通过取少量溶液甲于试管中,加入硫酸铜溶液,观察是否产生蓝色沉淀,验证是否有氢氧化钡;反应后的溶液中一定含有BaCl2,氯化钡和Ba(OH)2均会与硫酸钠反应产生白色沉淀,方案3不合理;③欲从溶液甲中获得纯净的日BaCl2固体,应采取的简单操作是测溶液甲的pH,若pH ≤7,蒸发结晶;若pH > 7,向溶液甲中加入盐酸至溶液pH ≤7,即将氢氧化钡转化成氯化钡,再蒸发结晶。(其他合理答案均可)
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究物质的化学反应,可以揭示物质之间转化的规律。
反应一:水在通电条件下生成氢气和氧气
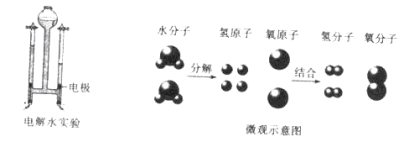
请写出电解水的化学方程式:____________。
反应二:氢气在空气中燃烧生成水
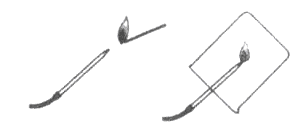
(1)根据所给信息,请画出氢气在氧气中燃烧生成水的微观示意图。
(2)该反应的文字表达式:___________。
(3)该反应的化学方程式:2H2+O2
 2H2O,其表示的含义:
2H2O,其表示的含义:表示1: ___________;
表示2: ___________;
表示3: ___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于单质碳的性质描述错误的是
A.单质碳在常温下化学性质不活泼
B.单质碳在充足的氧气中燃烧生成二氧化碳
C.高温时单质碳跟二氧化碳不反应
D.高温时碳跟氧化铜反应生成铜和二氧化碳
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的常用装盆,请回答下列问题:
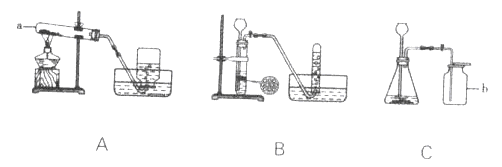
(1)写出图中标号仪器的名称:a______、b______。
(2)实验室可加热KMnO4固体制取O2 :
①请写出该反应的化学方程式______;
②如A所示,加热一段时间后,某同学发现试管口未放置棉花团,应采取的正确操作:______,再组装好仪器继续实验。
(3)实验室可用锌粒与稀硫酸反应制取H2,请写出该反应的化学方程式:______,应选用的装置是______(填字母)。
(4)实验室选用C装置制取CO2的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑
请计算:
①CO2的相对分子质量是______;
②现需收集4 瓶(每瓶0.125L) CO2气体(实验条件下CO2的密度为2g· L-1),其质量是____g;
③收集上述CO2至少需要大理石(含CaCO38O%)的质量是______g (精确到0.1g)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】AgNO3固体见光或受热易分解,故保存在棕色瓶中,AgNO3 见光分解时产生一种有刺激性气味的气体,该气体可能是
A. H2S B. SO2 C. N2 D. NO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】观察是学习化学的垂要方法。我们可以运用自己的感官,也可以借助仪器通过实验,观察物质及其变化的条件、现象和结果。
观察与思考一:蜡烛在空气中燃烧
观察与思考二:在密闭容器内,蜡烛燃烧过程中O2体积分数的测定
实验1:一定条件下,蜡烛在一瓶空气中燃烧。某同学利用O2传感器,测定燃烧过程中O2的体积分数。(如下图所示)
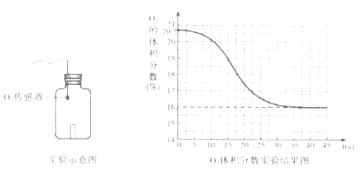
观察实验结果图,初始时O2的体积分数是_______%,蜡烛熄灭时O2的体积分数是_______%。
实验2:相同实验条件下,某同学另取一瓶混有空气的O2进行测定(初始时O2的体积分数是30%)。
结合已有信息,合理猜想:蜡烛熄灭时O2的体积分数(与实验1相比较)。
请写出两种不同情况并分别说明理由。
【温馨提示:实验操作合理,蜡烛相同且量足够,忽略仪器误差】
猜想1及理由:______________;
猜想2及理由:______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】对物质组成的叙述正确的是
A.纯净物的组成中只含一种元素
B.混合物的组成中肯定含有多种元素
C.不同物质可以含有相同的元素
D.含氧元素的化合物就是氧化物
相关试题

