【题目】探究金属活动性顺序时,将锌粒放入硫酸铜溶液中,锌粒表面有紫红色物质析出,还有无色无味气体产生的“异常”现象.推测该气体可能是
A.氢气 B.二氧化硫 C.二氧化碳 D.一氧化碳
参考答案:
【答案】A
【解析】
试题分析:根据质量守恒定律可知,反应前后原子的种类和数量不变,金属锌放入硫酸铜溶液中,产生的气体可能为氢气;因为反应物中没有硫元素、碳元素;故答案选择A
-
科目: 来源: 题型:
查看答案和解析>>【题目】有些游泳池中的水呈蓝色,是因为加入了一种能杀菌消毒的物质.这种物质可能是
A.硫酸亚铁 B.食盐 C.硫酸铜 D.硫酸铁
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知NH4NO3和KH2PO4固体混合物中氮元素的质量分数为14%,则混合物中KH2PO4的质量分数为
A. 80% B. 60% C. 40% D. 20%
-
科目: 来源: 题型:
查看答案和解析>>【题目】过氧化钙晶体(CaO2xH2O)是优良的供氧剂,受热会逐渐失水,120℃时完全分解为CaO2,350℃时CaO2迅速分解为CaO和O2。
(一)【性质探究】取少量CaO2于试管中加过量稀盐酸,无气泡产生;再加少量MnO2粉末,产生大量气泡。静置、取上层清液,逐渐加入碳酸钠溶液,先产生大量气泡,再出现白色沉淀。
(1)CaO2和盐酸发生复分解反应的化学方程式为____________________________。
(2)加入碳酸钠溶液,产生的气体是______;出现白色沉淀,说明上层清液中含________。
(二)【制备流程】
方法1:由Ca(OH)2为原料制备CaO28H2O流程如下:

陈化:让初生晶体和母液放置一段时间,使晶体由小长大。
(1)将反应2及陈化的化学方程式补充完整:
CaCl2+H2O2+2NH3H2O+6_____=CaO28H2O↓+2NH4Cl。
(2)检验固体是否洗净的方法是:___________________________________。
(3)制备过程中除水外可循环使用的物质是:___________(填化学式)。
方法2:由鸡蛋壳(含较多CaCO3)为原料制备CaO28H2O流程如下:

(4)反应器中由化合反应生成CaO2·8H2O,反应化学方程式为:_________________。
(5)在反应器中,应__________。
①先加水冷却后再加双氧水 ②先加双氧水冷却后再加水
(6)若煅烧充分,则获得的CaO28H2O中还含有的固体杂质是_______(填化学式)。
(7)“绿色化学”是指反应物的原子全部转化为期望的最终产物,则上述两种方法中生成CaO2·8H2O的反应符合“绿色化学”的是_________(填“方法1”或“方法2”)。
(三)【组成测定】若所得产品为CaO2·xH2O,下列装置可测定该产品的组成(样品中的杂质受热不反应)。

(1)实验前先缓慢通N2一段时间,控温将样品加热到350℃至CaO2分解完全;继续缓慢通N2,其目的是_________________________________(答一点即可)。
(2)装置B作用是________________(填序号)
①测定产生的H2O质量 ②便于观察和控制气流速度
(3)若2.7g样品,加热到350℃至CaO2分解完全,测得B装置重1.44g、C中铜网增重0.16g。
则x=________。
【反思】若先加热A,后加热C装置,测得X值______(填“偏大”、“偏小”或“不变”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各组离子在水中能大量共存,并形成无色透明溶液的是
A. Mg2+、Ca2+、OH-、CO32- B. Na+、NH4+、Cl-、NO3-
C. Fe3+、Ba2+、Cl-、SO42- D. H+、K+、MnO4-、SO42-
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国化学家侯德榜发明了联合制碱法,其生产工艺流程如图所示:
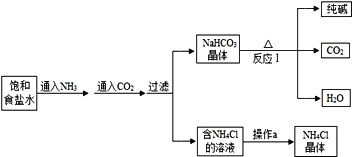
(1)纯碱溶液可以使无色酚酞试液变__色。
(2)写出反应I的化学方程式__。
(3)操作a的过程是蒸发浓缩、__、过滤。
(4)上述工艺流程中可循环利用的物质是__。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将X,Y,Z三种金属分别投入足量的稀硫酸中,只有X,Z能发生反应,并放出氢气.将Z投入X的硝酸盐溶液中,有金属X产生.则X,Y,Z三种金属的活动性由强到弱的顺序为
A.Z>Y>X B.Z>X>Y C.X>Z>Y D.Y>Z>X
相关试题

