【题目】图为元素周期表中部分元素的相关信息。
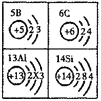
(1)原子序数为13的元素,x=___________。在化学变化中,该原子易___________(填“得”或“失”)电子形成离子,其离子符号是___________。
(2)硼(B)属于___________(填“金属”或“非金属”)元素。其化学性质与铝元素相似的原因是___________。
(3)碳酸中碳元素与硅酸中硅元素在周期表中属于同一纵行。两元素的最高正价相同,则硅酸的化学式为___________。
参考答案:
【答案】 8 失 Al3+ 非金属 硼和铝的最外层电子数一样 H2SiO3
【解析】本题考查了元素周期表信息和原子结构示意图。
(1) 原子序数为13的元素是铝元素。在原子中原子序数=核电荷数=核外电子数,则有13=2+x+3,x=8;该原子的最外层电子数为3少于4个,在化学变化中,该原子易失3个电子形成离子,其离子符号是Al3+;
(2)硼(B)属于非金属元素。其化学性质与铝元素相似的原因是硼和铝的最外层电子数一样;
(3)碳酸中碳元素与硅酸中硅元素在周期表中属于同一纵行。两元素的最高正价相同,碳元素的最高正价为+4,则硅酸的化学式为H2SiO3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】粗盐中含有较多的杂质,小林按照课本“活动与探究”的要求做粗盐提纯实验。
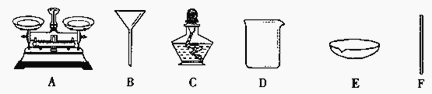
⑴仪器B的名称是________,在实验中用得最多的仪器是_________(填序号)。
⑵称量食盐应放在仪器A的_______盘,蒸发时防止液滴飞溅的操作是________________。
⑶“活动与探究”中,操作步骤有:①计算产率、②过滤、③溶解、④蒸发,正确的操作顺序为_________________(填序号)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣活动小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后锥形瓶中残留废液进行了探究。

【提出问题】
废液中所含溶质是什么物质?
【猜想与假设】
猜想(一):废液中的溶质可能是NaCl、Na2CO3和HCl。
猜想(二):废液中的溶质只有NaCl。
猜想(三):废液中的溶质是NaCl和HCl。
猜想(四):废液中的溶质是_______________________________________。
【讨论与交流】
小明认为猜想(一)无需验证就知道是错误的。他的理由是_______________。
【实验与结论】
(1)为验证猜想(二),小强同学取少量废液装入试管中,然后滴入AgNO3溶液,产生白色沉淀,滴加稀硝酸沉淀不溶解。于是小强认为猜想(二)正确。小强的实验________________(填“能”或“不能”)验证猜想(二)的正确性,原因是_______________。
(2)小丽为验证猜想(三),选用大理石做试剂。若猜想(三)是正确的,验证时反应的化学方程式为________________________________________。
(3)若验证猜想(四)是否正确,下列试剂中可选用的有_____________(填序号)。
①氢氧化钠溶液 ②氯化钙溶液
③稀盐酸 ④氯化钾溶液
【拓展与应用】
若废液中的溶质是NaCl和HCl,根据HCl的性质,无需另加试剂,只要对废液进行________________操作即可从废液中得到NaCl固体。此方法的缺点是__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组欲利用下列装置进行相关气体制取的探究,请你分析并填空。

(1)写出图中仪器a名称______________;
(2)实验室制取二氧化碳的化学方程式是________________,应选择的气体发生装置是__________(填序号);
(3)实验室用A装置制取氧气的化学方程式是________________,该反应为__________反应(填反应类型),若用盛满水的F装置收集氧气,应从导管________(填①或②)通入;
(4)实验室常用氯化铵固体与碱石灰固体共热来制取氨气,常温下,氨气是一种无色、有刺激性气味的气体,密度比空气小,极易溶于水;那么在制取和收集氨气时,应该从图中选择的发生装置是_________,收集装置是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质甲和乙的转化关系如图所示(“→”表示一步进行的反应)。
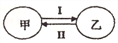
(1)若甲乙都是单质,甲是铁。
转化l反应的化学方程式为___________(写一个)。
转化Ⅱ为高温下,乙与氧化铁反应生成甲和水,该反应属于___________(填基本反应类型)。
(2)若甲、乙为元素种类相同的氧化物
①甲中含碳元素的质量分数高于乙转化Ⅱ的化学方程式为___________。
②若转化l发生的反应是CaO2+2H2O=X+Ca(OH)2,X为物质乙,乙的名称为___________。转化Ⅱ的化学方程式为___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定某黄铜(铜、锌合金)中铜的质量分数,称取32.5g该黄铜粉末放入烧杯中,再向烧杯内加入200g稀硫酸(足量),每隔10分钟测烧杯内(不含烧杯)剩余物质的质量,测得数据如表:
加入稀硫酸后10分钟
加入稀硫酸后20分钟
加入稀硫酸后
加入稀硫酸后40分钟
加入稀硫酸后50分钟
232.4g
232.3g
232.2g
232.1g
232.1g
(1)完全反应后生成氢气的质量为______g.
(2)计算该黄铜中铜的质量分数为________(写出计算过程).
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定某铜锌合金中锌的含量,取50g样品进行实验,将l00g稀盐酸分五次加入该样品中(杂质不溶于水也不参与反应,反应原理为:Zn+2HCl=ZnCl2+H2↑),充分反应后测得生成气体的总质量如表所示:
加入稀盐酸的质量/g
20
20
20
20
20
生成气体的总质量/g
0.05
0.10
m
0.20
0.20
试求:(1)m的数值为___________。
(2)该铜锌合金中锌的质量分数是___________?(写出计算过程)
相关试题

