【题目】(1)将相同规格光亮的铁丝同时放入下列装置中进行实验,试回答下列问题: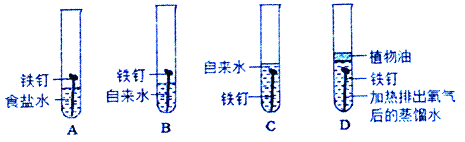
①一段时间后,铁钉一定无明显变化的_____(填字母,下同).
②大约一周时间后,将铁钉取出烘干,其质量由小到大的顺序为_____
③通过该实验可以得出铁制品锈蚀的条件为:_____
(2)为探究稀硫酸与氢氧化钠溶液的反应,设计下列实验方案:将稀硫酸溶液逐滴滴入含有无色酚酞的氢氧化钠溶液中,并用玻璃棒不断搅拌,PH值变化曲线如下图所示.
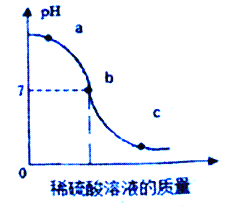
①实验过程中观察到的现象是:_____
②写出该反应的化学方程式:_____
③图中c 点溶液中的溶质是_____(写化学式)
参考答案:
【答案】 D D<C<B<A 与水和氧气同时接触 溶液由红色变成无色 2NaOH+H2SO4═Na2SO4+2H2O Na2SO4,H2SO4
【解析】(1)①铁在与水和氧气并存时易生锈,且盐能加速铁的锈蚀,图示中D中的铁钉与氧气隔绝,故不会生锈;
②A中的铁钉浸在食盐水中,锈蚀的速度快,B中的铁钉半浸入自来水中,会生锈,但是速度比A慢,C中的铁钉全部浸没在自来水中,溶解在水中的氧气很少,会生锈,但是不B中的要慢,而D中的铁钉不会生锈,故一周时间后,将铁钉取出烘干,其质量由小到大的顺序为D<C<B<A;
③通过该实验可以得出铁制品锈蚀的条件为与水和氧气同时接触;
(2)①由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中;恰好完全反应时溶液显中性,继续滴加稀盐酸,最终溶液显酸性,最终溶液显无色,实验过程中观察到的现象是溶液由红色变为无色;
②稀硫酸与氢氧化钠溶液反应生成硫酸钠和水,其反应方程式为:2NaOH+H2SO4═Na2SO4+2H2O;
③c点时溶液的pH小于7,溶液显酸性,说明稀硫酸过量,所得溶液中的溶质为Na2SO4、H2SO4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列反应属于置换反应的是( )
A. 丙烷燃烧:C3H8+5O2
 3CO2+4H2O
3CO2+4H2OB. 铝的冶炼:2Al2O3
 4Al+3O2↑
4Al+3O2↑C. 湿法炼铜:Fe+CuSO4═Cu+FeSO4
D. Cl﹣的检验:AgNO3+NaCl═NaNO3+AgCl↓
-
科目: 来源: 题型:
查看答案和解析>>【题目】等质量甲、乙、丙三种金属分别放入三份浓度相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如右图所示(已知甲、乙、丙在生成物中的化合价均为+2价)。则下列说法中错误的是( )
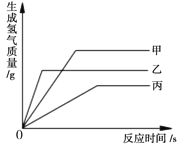
A. 生成氢气的质量:甲﹥乙﹥丙
B. 相对原子质量:乙﹥丙﹥甲
C. 金属活动性:乙﹥甲﹥丙
D. 消耗硫酸的质量:甲﹥乙﹥丙
-
科目: 来源: 题型:
查看答案和解析>>【题目】某校化学兴趣小组进行粗盐(含有泥沙)提纯实验,并利用所得精盐配制100g 20%的氯化钠溶液
实验一:如图1是甲同学进行粗盐提纯实验的操作示意图.

(1)写出标号仪器的名称:仪器A_____;仪器B_____
(2)操作①中的一处明显错误是_____.
(3)操作⑤对应的实验中,停止加热的恰当时机是_____.
(4)该同学实验中缺少过滤操作,在此操作中玻璃棒的作用是_____.
实验二:乙同学用提纯得到的精盐配制100g 20%的氯化钠溶液.
(5)需称取氯化钠_____g;水_____g
(6)若其他操作均正确,采用如图2所示观察方式量取水,则所配溶液的溶质质量分数_____(填“>”、“<”或“=”)20%.
-
科目: 来源: 题型:
查看答案和解析>>【题目】国家规定:从2011年5月1日起,在公共场所内禁止吸烟。请你结合化学知识从环境、健康、安全等方面回答这样做的好处(答出三点即可)。

-
科目: 来源: 题型:
查看答案和解析>>【题目】自行车作为常用代步工具,既轻便灵活,又符合环保要求,如下图是一款自行车示意图,
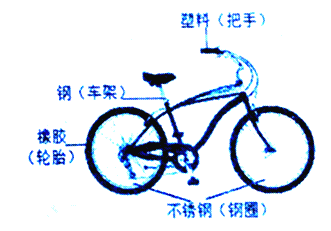
(1)所标物质中,属于有机合成材料的是图中自行车的哪些部位_____
(2)车架表面刷漆主要是为了防锈,请再提出一条可延长自行车使用寿命的建议._____
(3)当今自行车外形美观,材质轻便、牢固,除了代步,还可以作为健身工具.由此你对化学与人类生活的关系有何感想?_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两种固体物质的溶解度曲线如图所示,请回答问题:
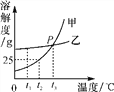
(1)t1 ℃时,甲、乙两种物质的溶解度大小关系为甲________(填“<”“>”或“=”)乙;
(2)P点的含义___________;
(3)t2 ℃时,把20 g固体甲放入50 g水中,充分搅拌,所得溶液的质量是________g;
(4)欲将t2 ℃时乙物质的不饱和溶液变为该温度下的饱和溶液,可采取的一种方法是________________;
(5)如果甲物质中含有少量乙物质,若要提纯甲,一般采用________的方法。
相关试题

