1.
A.砷元素符号为As,位于元素周期表中第四周期、ⅤA B.酸性:砷酸>磷酸
C.镓元素符号为Ga,单质不能与水反应 D.碱性: Ga(OH)3<Al(OH)3
2.下列叙述正确的是
A.合成氨工业、硫酸工业中均用到吸收塔这一设备
B.玻璃、水泥的工业生产中均用到纯碱和石灰石作为原料
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅
D.绿色化学的核心思想是利用绿色植物治理环境污染
3.乙醇可通过淀粉等生物质原料发酵制得,属于可再生资源,通过乙醇制取氢气具有良好的应用前景。已知通过乙醇制取氢气有如下两条路线:
a. 水蒸气催化重整:CH3CH2OH(g) + H2O(g) ® 4H2(g) + 2CO(g) △H=+255.58 kJ・mol-1
b. 部分催化氧化:CH3CH2OH(g)
+ 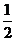 O2(g) ® 3H2(g)
+ 2CO(g) △H=+13.76 kJ・mol-1
O2(g) ® 3H2(g)
+ 2CO(g) △H=+13.76 kJ・mol-1
则下列说法错误的是
A.从原料消耗的角度来看,a路线制氢更有价值
B.从能量消耗的角度来看,b路线制氢更加有利
C.a路线制氢由于要消耗很多能量,所以在实际生产中意义不大.
D.降低温度,可提高b路线中乙醇的转化率
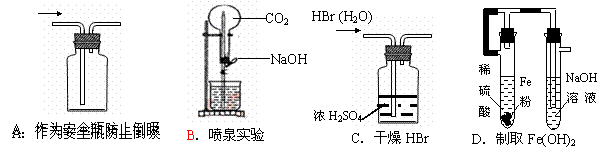
4.下列能达到实验目的的是
5.阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定错误的是
A.
B.
C.0.5 mol超重水(T2O)的质子总数约为5×6.02×1023
D.
6.某溶液中若加入KSCN溶液出现血红色。则该溶液中可能大量存在的离子组是
A.Na+、K+、S2―、Cl― B.H+、Na+、I-、NH4+
C.K+、Ba2+、OH―、NO3― D.Na+、Cl―、SO42―、Fe2+
7.有关键能数据如表:
化学键
Si―O
O=O
Si―Si
键能/kJ・mol-1
X
498.8
176
晶体硅在氧气中燃烧的热化学方程式:Si(s)+O2(g)ㄔSiO2(s) △H= ―989.2 kJ・mol-1,则表中X的值为
A.460
B.
8.t℃时,将
A.a+b>c B.若x>y ,则a<b
C.t℃时,A的溶解度为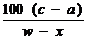 g
D.t℃时,A的溶解度为
g
D.t℃时,A的溶解度为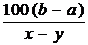 g
g
9.下列离子方程式表达正确的是
A.Ca(HCO3)2溶液与Ca(OH)2溶液任意比混合;Ca2++HCO3―+OH―ㄔCaCO3↓+H2O
B.FeCl3溶液与Na2S溶液任意比混合:2Fe3++S2―ㄔ2Fe2++S↓
C.向NH4HCO3溶液中加入足量NaAlO2溶液:NH4++AlO2―+2H2O= NH3・H2O+ Al(OH)3↓
D.将SO2气体通入NaClO溶液中:SO2 + 2ClO-+ H2O = SO32- + 2HClO
10.相同条件下,因溶液浓度不同,化学反应方程式表达可能不同的是
A.Zn与H2SO4(aq) B Al与NaOH(aq) C Mg与HCl(aq) D Cu与HNO3(aq)
11.下列实验操作中,正确的是
①用托盘天平称取
③用蒸发皿加热NaCl溶液可以得到NaCl晶体 ④用100 mL容量瓶配制50 mL 0.1mol•L―1 H2SO4溶液
⑤用带玻璃塞的棕色试剂瓶存放浓HNO3
⑥中和热测定的实验中使用的玻璃仪器只有2种
A.①③⑤ B.②④⑥ C.①③④ D.③⑤⑥
12.电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-,其化学方程式为(漂白粉用ClO-表示): aCN- + bClO- + cH2O = dHCO3- +e N2↑ + fCl-。下列说法正确的是
A.还原剂是含氰化物,氧化产物只有N2 B.氧化剂是漂白粉,还原产物是HCO3-
C.a=d=2,b=f=5
D.若生成标准状况下
13.下列叙述正确的是
A.同温度下完全中和相等pH相等体积的氨水、NaOH、Ba(OH)2,所需相同浓度的盐酸体积相等
B.某温度下0.1mol•L-1的NaHB溶液中,c(Na+)= 0.1mol•L-1≥c(B2-)
C.在0.1 mol・L-1醋酸铵(CH3COONH4)溶液中,c(H+)=c(NH3•H2O)+c(OH-)
D.0.1mol/L (NH4)2Fe(SO4)2溶液中,c(SO42―) >c(NH4+)>c(Fe2+)>c(H+)>cOH―)
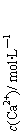
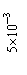
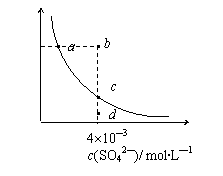 14.常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
14.常温下,Ksp(CaSO4)=9´10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42―)对应于曲线上任
意一点
B.b点将有沉淀生成,平衡后溶液中c(SO42―)一定等于3´10-3 mol・L―1
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
第Ⅱ卷(非选择题,共72分)
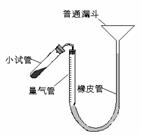 15.(12分)过氧化钙是重要的工业原料,
15.(12分)过氧化钙是重要的工业原料,
(1)上述制备工艺中,分离主产品的操作方法是______、烘干,分离出副
产品的操作方法是 。
(2)右图装置,检查系统是否漏气的方法是 。
(3)正确读取量气管内液面的初、终读数前都需进行的操作是___,加热小试管
时,随着过氧化钙分解,量气管内的液面逐渐下降,为防止试管和量气管内气体压强过大。可进行的操作是_________________________.
(4)已知:样品质量m g,量气管初读数a mL,终读数b mL,该实验条件下,Vm=c L・mol?1。计算样品中过氧化钙的含量表达式为 w%=_______________________。
16.(6分)根据下表中序号1提供的探究样例,设计实验探究方案(要求方案尽可能简单)。
序号
探究问题的两种不同猜想
设计实验探究方案
(1)
向品红溶液中通入一种常见气体后,品红褪色。
甲:通入的是氯气。
乙:通入的是二氧化硫。
实验设计:将褪色后的溶液加热,若红色再现,则通入的是二氧化硫,乙正确;若不再变红,则通入的气体是氯气,甲正确。
(2)
在含有酚酞的氢氧化钠溶液中,滴加新制氯水,边滴边振荡,直到红色刚好褪去。
甲:氯水中的HCl、HClO中和NaOH所致。
乙:氯水中的HClO具有强氧化性使红色酚酞褪色。
实验设计:
。
(3)
加热稀氨水,溶液中的c(OH一)的变化。
甲:c(OH一)将增大。升高温度有利于电离平衡移动,使氨水中c(OH一)增大。
乙:c(OH一)将减小。受热时氨易逸出,使c(OH一)减小。
实验设计:
。
(4)
在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。
甲: NH4Cl水解产生的H+与Mg(OH)2电离出来的OH一发生中和反应而使Mg(OH)2溶解。
乙:NH4Cl电离出的NH4+与Mg(OH)2电离出的OH一结合成弱电解质NH3・H2O,使Mg(OH)2的溶解平衡向右移动,使Mg(OH)2溶解。
实验设计:
(提示:选择合适试剂加入到Mg(OH)2悬浊液中)
。
17.(12分)氯化亚铜是一种重要的化工产品,常用作有机合成催化剂, 还可用于颜料, 防腐等工业。该物质露置于空气中易被氧化为绿色的高价铜盐,在热水中易水解生成氧化铜水合物而呈红色。以下是一种采用亚硫酸盐还原法,从含铜电镀废水中制备氯化亚铜的工艺流程图。
 请回答以下问题:
请回答以下问题:
(1)写出反应①制备氯化亚铜的离子反应方程式: 。
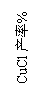
 (2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5。这样做的目的是 。
(2)为提高CuCl的产率,常在反应①的体系中加入稀碱溶液,调节pH至3.5。这样做的目的是 。
(3)右图是各反应物在最佳配比条件下,反应温度对CuCl产率影响。由图可知,溶液温度控制在
时,CuCl产率能达到94%。随后随温度升高CuCl产率
会下降,其原因是 。
(4)若要提高CuCl的产率你认为还可采取的措施
有 。
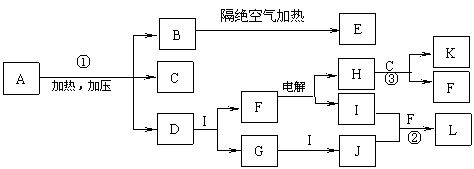 18.(10分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。B为一种白色固体,其化学式可表示为X3Y
18.(10分)已知下图每一方框中的字母代表一种反应物或生成物(图中部分生成物没有列出)。化合物A是一种常用的肥料,其化学式可表示为XY4ZM2,组成A的四种元素都是短周期元素、其原子序数之和为22,X、M、Z分别位于相邻的主族,原子序数依次增大。C、D、G、I、J、K为气体,其中C、K的温室效应均显著,K是含碳量最高的有机物,D能使湿润的红色石蕊试纸变蓝。B为一种白色固体,其化学式可表示为X3Y
(1)反应①、②、③的化学方程式分别为 、 、 。
(2)B中M的质量分数为 。
(3)化合物E是一种新型无机材料,它的一种结构(β- X
五、(本题包括1小题,12分)
19.(12分)高铁酸盐(如K2FeO4)是一种高效绿色氧化剂,可用于废水和生活用水的处理。从环境保护的角度看,制备高铁酸盐较好的方法为电化学法。
(1)电化学法制备高铁酸钠采用铁片作阳极,NaOH溶液作为电解质溶液,其电流效率可达到40%。写出阳极的电极反应式: 。
(2)铁丝网电极是更理想的阳极材料,相同条件下,可将电流效率提高至70%以上,原因是 。研究亦发现,铁电极在某一电压范围内会生成Fe2O3膜而“钝化”,钝化的原因可能是 。
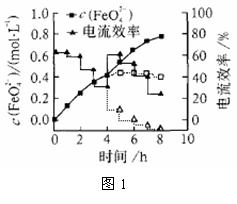 (3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图1中4 h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1 h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是( )
(3)FeO42-易与水反应生成絮状氢氧化铁,也会影响高铁酸盐的产率。若以铁丝网为阳极,在中间环节(对应图1中4 h后)过滤掉氢氧化铁,合成过程中FeO42-浓度以及电流效率随时间的变化如图1中实线所示(图中曲线是每隔1 h测得的数据)。图中虚线部分对应于没有过滤氢氧化铁而连续电解的情况。下列判断正确的是( )
A.过滤掉氢氧化铁有利于获得较高浓度的高铁酸盐溶液
B.过滤掉氢氧化铁对电流效率影响不大
C.实验表明氢氧化铁的存在影响高铁酸盐浓度的增加
D.实验表明不过滤掉氢氧化铁,6 h后电流效率几乎为0
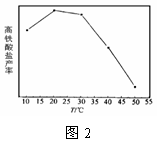
(4)碱性条件下,高铁酸盐的稳定性与温度有关(如图2)。随温度升高,高铁酸盐产率先增大后减小的原因是 。
 (5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于( )
(5)人们还对用铁的氧化物作电极制备高铁酸盐进行了研究,例如以磁铁矿多孔电极制备高铁酸盐,该研究方向的价值在于( )
A.将1 mol Fe3O4氧化成高铁酸盐需10/3 mol电子,可提高电流效率
B.以低价态铁的氧化物为电极,可以实现变废(铁锈)为宝(高铁酸盐)
C.自然界几乎没有铁单质,而有大量磁铁矿,该方法的原料来源广泛
D.磁铁矿作为多孔电极不会出现钝化现象
六、(本题包括1小题,共10分)
20.(10分)在 2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在
2NO(g)+O2(g)在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在
(1)对比实验Ⅰ、Ⅱ和Ⅲ,得出的下列结论中正确的是 。(填字母)
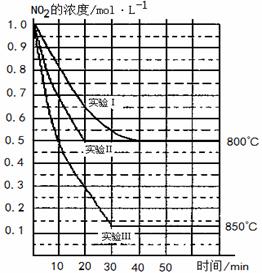 A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容
A. 实验Ⅱ和实验I相比,可能隐含的反应条件是:反应容
器的体积缩小了
B.实验Ⅱ和实验I相比,可能隐含的反应条件是:使用效
率更高的催化剂
C.实验I条件下该反应的平衡常数大于实验Ⅲ条件下该反
应的平衡常数
D.对比实验Ⅰ和Ⅲ可知,该反应是吸热反应
(2) 若实验Ⅰ中NO2的起始浓度改为1.2 mol・L-1,其它条件不变,则达到平衡时所需用的时间 40 min(填写“大于”、“等于”或“小于”) ,NO2的转化率将 (填写“增大”、“减小”或“不变”)。
(3)若实验Ⅰ中达平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与NO混合气体(保持温度不变),则平衡将 移动,新平衡状态时NO2的物质的量浓度为 mol・L-1。
(4)若将实验Ⅲ所得的平衡混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气 L。(设空气中N2与O2体积比4:1)
七、(本题包括1小题,共10分)
21.(10分)已知
(1)该反应的离子方程式为 。
(2)取阳极区溶液作系列实验,下列结论中错误的是 。(填字母)
A.滴加酚酞试剂,先变红后褪色 B.滴加硝酸银溶液,有白色沉淀产生
C.滴加小苏打溶液,有气泡产生 D.做焰色反应实验呈黄色
(3)计算原饱和NaCl溶液的质量(单位:kg)。
(4)若电解90%的NaCl所需电能是由甲烷燃料电池提供,则所需甲烷至少为多少m3?(折算成标准状况,假设该燃料电池的电量利用率为90%)
扬州市2008-2009学年度高三第一次调研测试