16.(6分)根据下表中序号1提供的探究样例,设计实验探究方案(要求方案尽可能简单)。
序号
探究问题的两种不同猜想
设计实验探究方案
(1)
向品红溶液中通入一种常见气体后,品红褪色。
甲:通入的是氯气。
乙:通入的是二氧化硫。
实验设计:将褪色后的溶液加热,若红色再现,则通入的是二氧化硫,乙正确;若不再变红,则通入的气体是氯气,甲正确。
(2)
在含有酚酞的氢氧化钠溶液中,滴加新制氯水,边滴边振荡,直到红色刚好褪去。
甲:氯水中的HCl、HClO中和NaOH所致。
乙:氯水中的HClO具有强氧化性使红色酚酞褪色。
实验设计:
。
(3)
加热稀氨水,溶液中的c(OH一)的变化。
甲:c(OH一)将增大。升高温度有利于电离平衡移动,使氨水中c(OH一)增大。
乙:c(OH一)将减小。受热时氨易逸出,使c(OH一)减小。
实验设计:
。
(4)
在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。
甲: NH4Cl水解产生的H+与Mg(OH)2电离出来的OH一发生中和反应而使Mg(OH)2溶解。
乙:NH4Cl电离出的NH4+与Mg(OH)2电离出的OH一结合成弱电解质NH3・H2O,使Mg(OH)2的溶解平衡向右移动,使Mg(OH)2溶解。
实验设计:
(提示:选择合适试剂加入到Mg(OH)2悬浊液中)
。
- 答案
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
C
D
B
D
D
A
C
A
AD
A
C
BD
D
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共18分)
15.(12分)(1)过滤(2分) 蒸发、结晶(2分) (2)从漏斗向量气筒内注入一定量的水,连接好装置,移动漏斗形成液面高度差,静置后,液面高度不再变化,即表明气密性良好。(其他合理方法均给分)(2分)
(3)移动漏斗保持液面与量气筒液面相平,防止试管和量气筒内气体压强过大 (4分,各2分)
(4) %(2分)
%(2分)
16.(6分,各2分)(2)向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色复出,则是因为HCl和HClO的酸性所致,甲正确;若红色不再复出,则是因为HClO的强氧化性所致,乙正确。
(3)在试管中注入滴有酚酞的氨水,加热试管,观察溶液颜色变化,如果颜色变浅,则加热使氨水中的c(OH一)减小,乙正确;如颜色变深,则加热使氨水中的c(OH一)增大,甲正确。
(4)向Mg(OH)2沉淀中加入中性的醋酸铵浓溶液,加入后若Mg(OH)2不溶解,甲正确;加入后若Mg(OH)2溶解,则乙正确。
四、(本题包括2小题,共22分)
17.(12分,每空2分)(1)
(2)减小 , OH―中和了反应中的H+,有利于平衡向右进行,提高CuCl的产率。但当OH―浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降减了CuCl的产率。
注此答案同题目不一致
(3)
(4)反应①在隔绝空气条件下进行。
18.(10分,每空2分)
(1)6(NH2)2CO → C3H6N6 + 6NH3 + 3CO2、4NO2 + O2+2H2O = 4HNO3、 CO2+4H2→CH4 +2H2O
(2)66.7% (3)做耐磨材料等。
五、(本题包括1小题,共12分)
19.(12分)
(1)Fe-6e-+8OH-ㄔFeO42-+4H2O(2分)
(2)铁丝网的接触面积更大。(2分)因为铁电极上发生析氧反应4OH--4e-ㄔO2↑+2H2O,氧气将铁氧化而得到氧化铁膜。(也可以直接写电极反应式或综合式:6OH--6e-+2FeㄔFe2O3+3H2O)(2分)
(3)ACD(2分,对1―2个给1分,全对得2分,错1个扣1分)
(4)升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解,10~
(5)BCD(2分,对1―2个给1分,全对得2分,错1个扣1分)
六、(本题包括1小题,共10分)
20.(10分)(1)BD (2分,对1个得1分,多选1个扣1分,扣完为止) (2)小于,减小 (2分)
(3)不,1.0(4分,各2分) (4)56(2分)
七、(本题包括1小题,共10分)
21.(10分)(1)2Cl―+2H2O=2OH―+Cl2↑+H2↑(2分)
(2)A(2分)
(3)n(H2)=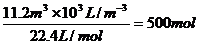 n(已电解NaCl)=500
mol´2=1000
mol(1分)
n(已电解NaCl)=500
mol´2=1000
mol(1分)
n(总NaCl)=1000
/0.9 mol m(总NaCl)=
1000 /0.9 mol´
m(NaCl溶液)=
(4)由n(H2)=500 mol得:n(CH4)= 500 mol´2/8=125 mol(2分)
V(CH4)= 125 mol ´

