1.取三张蓝色石蕊试纸放在表面皿上,然后按顺序分别滴加微热的65%的HNO3溶液;98.3%的H2SO4和新制氯水,三张试纸最后呈现的颜色分别是 ( )
A.白、红、白 B.红、黑、红 C.红、红、红 D.白、黑、白
2.下列各项中的两个量,其比值一定为2:1的是 ( )
A.相同温度下,0.2mol/L的醋酸与0.1mol/L的醋酸中的H+浓度
B.在密闭容器中,N2+3H2
 2NH3已达平衡时c(NH3)与c(N2)
2NH3已达平衡时c(NH3)与c(N2)
C.在反应2FeCl3+Fe=3FeCl2中还原产物与氧化产物的质量
D.液面均在“
3.最近美国宇航局(NASA)马里诺娃博士找到了一种比二氧化碳有效104倍的“超级温室气体”―全氟丙烷(C
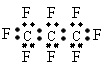 A.C
A.C
B.全氟丙烷的电子式为:
C.相同压强下,沸点:C
D.全氟丙烷分子中既有极性键又有非极性键
4.
A.该溶液可能是酸或碱溶液
B.该溶液是盐溶液
C.该溶液中c(OH-)=10-5 mol/L
D.该溶液与pH=9的氢氧化钠溶液等体积混合,混合后溶液可能呈中性
5.NA为阿伏加德罗常数,下列说法正确的是( )
A.1molFe3+完全水解生成氢氧化铁胶体粒子的数目为NA
B.常温常压下,32gO2-离子中所含电子的数目为17 NA
C.标准状况下,
D.
6.下列关于硅和硅的化合物叙述不正确的是( )
①硅晶体的结构和金刚石相似,都是原子晶体;
②硅是地壳中含量最多的元素;
③单晶硅是良好的半导体材料;
④二氧化硅是制造光导纤维的重要原料;
⑤二氧化硅分子是由两个氧原子和一个硅原子组成的;
⑥二氧化硅是酸性氧化物,它不溶于任何酸。
A.①②③ B .①⑤⑥ C.③④⑤ D. ②⑤⑥
7.能正确表示下列反应的离子方程式的是( )
A.向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+
B. 用NaOH溶液吸收过量的硫化氢气体:2OH-+H2S=S2-+2H2O
C.
|

 9.要证明某种盐的水解反应是吸热的,有四位同学设计实验如下,其中不正确的是( )
9.要证明某种盐的水解反应是吸热的,有四位同学设计实验如下,其中不正确的是( ) 、H
、H
 2H2O
2H2O
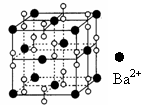 18.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法不正确的是( )
18.钡在氧气中燃烧时得到一种钡的氧化物晶体,其结构如下图所示,有关说法不正确的是( )
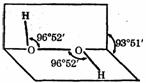 卷Ⅱ(非选择题,共45分)
卷Ⅱ(非选择题,共45分)
 卷Ⅱ(非选择题,共45分)
卷Ⅱ(非选择题,共45分) ⑵①题目是《
》;
⑵①题目是《
》;