【题目】乙烯是重要的有机合成基础原料。以下是由乙烯合成高分子化合物PVB、缩醛M、碳酸二甲酯等重要有机物的合成路线。
 已知:醛与二元醇可生成环状缩醛:
已知:醛与二元醇可生成环状缩醛:![]()
请回答下列问题:
(1)B的名称是______________, C的名称是__________。
(2)反应③的反应类型是_____________,缩醛M的分子式是_____________。
(3)反应④的化学方程式是___________。
(4)D的结构简式是 ___________。
(5)缩醛M有多种同分异构体,其中属于羧酸,且苯环上只有两个取代基的同分异构体共有_______种。
(6)参照的合成路线,设计一条由2-溴丙烷制备 的合成路线(注明必要的反应条件):
的合成路线(注明必要的反应条件):
_________________________________________。
参考答案:
【答案】 苯乙醛 乙二醇 取代反应 C10H12O2 CH3CH2CH2CHO ![]() 15
15 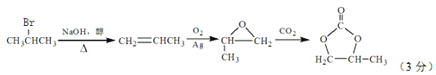
【解析】试题分析:根据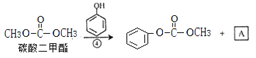 ,可知A是甲醇;
,可知A是甲醇;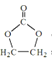 与甲醇反应生成C和碳酸二甲酯,所以C是HOCH2CH2OH;乙二醇与B反应生成
与甲醇反应生成C和碳酸二甲酯,所以C是HOCH2CH2OH;乙二醇与B反应生成![]() ,B的结构是
,B的结构是![]() ;
; ,D是丁醛;
,D是丁醛;
解析:(1)![]() 的名称是苯乙醛, HOCH2CH2OH的名称是乙二醇。
的名称是苯乙醛, HOCH2CH2OH的名称是乙二醇。
(2) 与甲醇反应生成乙二醇和碳酸二甲酯的反应类型是取代反应,根据结构简式
与甲醇反应生成乙二醇和碳酸二甲酯的反应类型是取代反应,根据结构简式![]() 的分子式是C10H12O2;
的分子式是C10H12O2;
(3)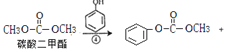 甲醇
甲醇
的化学方程式是![]() 。
。
(4)D是丁醛,结构简式是CH3CH2CH2CHO。
(5)缩醛M有多种同分异构体,其中属于羧酸,且苯环上只有两个取代基的同分异构有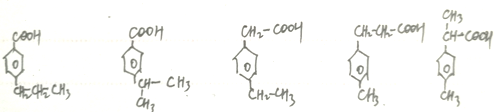 各有邻、间、对3种,共15种。
各有邻、间、对3种,共15种。
(6)根据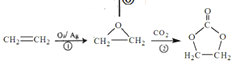 ,
,
由2-溴丙烷制备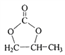 ,先由2-溴丙烷消去,制取丙烯,再氧化为甲基环氧乙烷,合成路线为
,先由2-溴丙烷消去,制取丙烯,再氧化为甲基环氧乙烷,合成路线为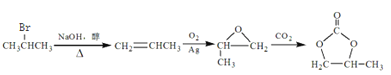 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】煤燃烧的烟气中含有SO2和NO,直接排放会形成酸雨、污染大气,因此对烟气进行脱硫、脱硝具有重要意义。
(1)选择性催化还原技术是目前成熟的烟气脱硝技术,即在金属催化剂作用下,用还原剂(如NH3)选择性地与NO反应生成N2和H2O。
①已知:4NH3(g) + 5O2(g)
 4NO(g) + 6H2O(g) ΔH = -905.5kJ/mol
4NO(g) + 6H2O(g) ΔH = -905.5kJ/molN2(g) + O2(g)
 2NO(g) ΔH =+180 kJ/mol
2NO(g) ΔH =+180 kJ/mol则该方法中主要反应的热化学方程式是(请补充完整):
4NH3(g) + 4NO(g) + O2(g)
 4N2(g) + 6H2O(g) ΔH =_________
4N2(g) + 6H2O(g) ΔH =_________②该方法控制反应温度在315~400℃之间,反应不宜过低也不能过高的原因是_________。
③氨氮比[n(NH3)/n(NO)]的大小会影响该方法的脱硝率。350℃时,只改变NH3的投放量,反应物X的转化率与氨氮比的关系如右图,则X是_____(填化学式)。氨氮比由0.5增加到1.0时,脱硝主要反应的平衡将向____________方向移动。当氨氮比大于1.0时,烟气中NO浓度反而增大,主要原因是___________。
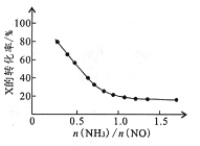
(2)将烟气中的SO2、NO经O3处理后,再用CaSO3悬浊液吸收,可脱硫、脱硝。
已知:O3氧化烟气中SO2、NO的主要反应为:
NO + O3
 NO2 + O2; 2NO + O2
NO2 + O2; 2NO + O2 2NO2; SO2+ O3
2NO2; SO2+ O3 SO3 + O2
SO3 + O2用CaSO3悬浊液(pH=8)吸收经O3处理后的烟气时,NO2转化为NO2-,离子方程式为
_____________。
② 在CaSO3悬浊液中加入Na2SO4溶液可提高NO2的吸收速率,请结合化学原理进行解释___________________________。
③烟气经处理后最终得到含Na+、NO2-、SO42-的吸收液。t℃时,向吸收液中加入AgNO3溶液至SO42-恰好完全沉淀(即SO42-浓度等于1.0×10-5 mol·L-1)时,c(NO2-)=_______mol/L。[t℃时,AgNO2(亚硝酸银)的 Ksp= 9.0×10-4、Ag2SO4的Ksp=4.0×10-5。]
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上以铬铁矿(含有Cr2O3,FeO、Al2O3、SiO2等成分)为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O),其主要工艺流程如下:
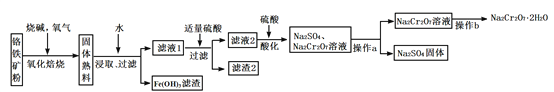
提示:熟料中含有Na2CrO4、NaFeO2等成分。
回答下列问题:
(1)将铬铁矿粉碎的目的是_____________________________ 。
(2)氧化焙烧时,生成Na2CrO4的化学方程式是__________。
(3)滤渣2中除Al(OH)3外还有__________(填化学式)。
(4)加入硫酸酸化的目的是__________________________。
(5)根据下图,请将操作a补充完整:________________,洗涤,干燥。
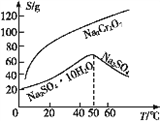
(6)控制105~110℃,向较浓的Na2Cr2O7溶液中加入KCl固体发生复分解反应,立即析出K2Cr2O7晶体。能生成K2Cr2O7晶体的原因是_____________。
(7)向Na2Cr2O7酸性溶液中加入过量FeSO4溶液,生成Cr3+和 Fe3+,再加入过量的强碱溶液生成铁铬氧体沉淀(CrxFe3-xO4)。加入过量强碱生成铁铬氧体沉淀的离子方程式是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学习小组分析实验室制氯气的方法后认为:MnO2与FeCl3·6H2O共热能产生Cl2,于是设计了下列装置验证该结论。
【查阅资料】FeCl3·6H2O是棕黄色晶体,熔点37℃,沸点280~285℃。
【实验设计】
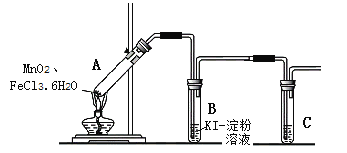
若结论成立,B中发生反应的化学方程式是___,C中的试剂是___。
【实验过程】
操作
现象
(1)经检查,装置气密性良好。
(2)添加药品,连接装置。
(3)点燃酒精灯。
i.A中部分固体熔化,上方出现白雾;
ii.稍后,产生黄色气体,管壁附着黄色液滴;
iii.B中溶液变蓝。
【实验分析】
(1)小组讨论一致认为现象i中的白雾是盐酸小液滴,产生白雾的原因是___。
(2)分析现象ii时发生了分歧,有同学认为:FeCl3·6H2O是棕黄色,沸点不高,黄色气体重含有FeCl3也会导致B中溶液变蓝,反应的离子方程式是___。
小组同学通过下列实验证明现象ii的黄色气体中含有Fe3+,将下列实验补充完整:
a.只在A中加入FeCl3·6H2O,加热,开始产生白雾,稍后出现黄色气体,管壁仍有黄色液滴。
b.____________________________________ ,溶液变红。
(3)为进一步确认黄色气体含有 Cl2,小组在A、B 间增加盛有饱和氯化钠溶液的试管,气体依次通过饱和氯化钠溶液、KI淀粉溶液后,KI淀粉溶液变蓝,证实黄色气体中含有Cl2。饱和氯化钠溶液的主要作用是___。
(4)A中固体充分加热后得到Fe2O3和MnCl2,若物质的量之比为1:1,则A中总反应的化学方程式是________。从混合物中分离出Fe2O3的方法是:___。
【安全预案】在实验过程中,若试管B中溶液已经开始发生倒吸,应立即采取的一种措施是___ (填写编号)。
a.移去酒精灯
b.取下B中盛有溶液的试管
c.将A、B间的导管从乳胶管中取出
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图中甲、乙是电化学实验装置图,丙是氯碱工业生产示意图。

(1)若甲、乙两装置的烧杯中均盛有
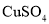 溶液,反应一段时间后:
溶液,反应一段时间后:①表面有红色物质析出的电极是:甲装置中的_______棒,乙装置中的________棒。
②乙装置中碳棒表面发生的电极反应式是______________________。
③若起始时乙中盛放100 mL
 溶液,一段时间后要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入2.22g的碱式碳酸【Cu2(OH)2CO3】,则电解过程中转移电子数为______________
溶液,一段时间后要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入2.22g的碱式碳酸【Cu2(OH)2CO3】,则电解过程中转移电子数为______________(2)若甲、乙两装置的烧杯中均盛有饱和NaCl溶液;
①写出甲装置中碳棒表面发生的电极反应式:______________________________。
②已知:
 ,将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为__________________________。
,将湿润的淀粉KI试纸放在乙装置的碳棒附近,现象为__________________________。③工业上经常用到离子交换膜,离子交换膜有阳离子交换膜和阴离子交换膜两种,阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过。当乙中的反应用于工业生产时,为了阻止两极产物之间的反应,通常用如丙图所示的装置,
 的移动方向如图中标注,则
的移动方向如图中标注,则 的出口是_______(填“C”、“D”、“E”或“F”);电解一段时间后,如果阴极产生气体的体为112 mL(标准状况)时,停止通电,通过阳离子交换膜的阳离子物质的量为______ mol。
的出口是_______(填“C”、“D”、“E”或“F”);电解一段时间后,如果阴极产生气体的体为112 mL(标准状况)时,停止通电,通过阳离子交换膜的阳离子物质的量为______ mol。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下面图(1)和图(2)是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图(1)和图(2)两种物质的核磁共振氢谱图选择出可能属于图(1)和图(2)的两种物质 ( )

A. A是C3H8;B是C6H6 B. A是C4H10;B是C6H6
C. A是C3H6;B是C3H6 D. A是C3H6;B是C2H6
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:短周期元素A、B、C、D、E的原子序数依次增大。
①C的简单气态氢化物遇湿润的红色石蕊试纸变蓝色;
②A与D可以形成原子个数比分别为2∶1、1∶1的两种液态化合物X和Y,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种化合物F,其组成原子数之比为5∶1∶1∶3。
请回答下列问题:
(1)C原子在周期表的位置为___________;写出化合物EDA的电子式________。
(2)C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐,写出其化学式________;
(3)F溶液与足量EDA的稀溶液混合加热,其离子方程式为_____________________。
(4)氯气与C的简单气态氢化物相遇有白烟及C2生成,写出反应方程式_____________。
(5)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)
 N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-1
N2(g)+CO2(g)+2H2O(l) ΔH=-955 kJ·mol-12NO2(g)
 N2O4(g) ΔH=-56.9 kJ·mol-1
N2O4(g) ΔH=-56.9 kJ·mol-1写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:___________________。
相关试题

