【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
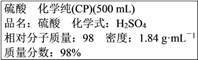
(1)通过计算可知,上述浓硫酸中H2SO4的物质的量浓度为__________molL-1。
实验室需要240 mL 2.0 mol·L-1的H2SO4溶液,现用以上浓硫酸配制,请回答下列问题:
(2)下列仪器中,不会用到的是________。
A.50 mL量筒 B.100 mL容量瓶 C.玻璃棒 D.托盘天平 E.药匙 F.烧杯
(3)若要实施配制,除上述仪器外,还缺少的仪器为________。
(4)请先通过计算____(请把计算过程写在框内),再确定量取________mL浓硫酸溶液用于稀释。
(5)配制过程简述为以下各步,其正确的操作顺序为_________________(填各步骤序号)。
A.冷却至室温 B.洗涤并移液 C.量取 D.稀释 E.摇匀装瓶 F.定容 G.移液
(6)在配制过程中,下列情况对配制结果有何影响?(填“偏高”“偏低”或“无影响”)
①容量瓶未干燥,有少量蒸馏水,则所配溶液的浓度________;
②定容时若仰视刻度线,则所配溶液的浓度________;
③量取浓硫酸时若俯视刻度线,则所配溶液的浓度________;
④摇匀后,发现液面低于刻度线,再加水至刻度线________。
参考答案:
【答案】 18.4 BDE 250mL容量瓶、胶头滴管 27.2mL 稀溶液有n=C稀V稀=2.0mol/L × 0.25L=0.5mol,浓溶液的体积V浓=n/C浓=0.5mol/18.4molL-1=27.2mL(保留一位小数才给分) CDAGBFE 无影响 偏低 偏低 偏低
【解析】(1)根据![]() 可知该浓硫酸的物质的量浓度为:
可知该浓硫酸的物质的量浓度为: ![]() ;(2)没有240mL容量瓶,需要配制250mL溶液,需要硫酸的物质的量为:2.0mol/L×0.25L=0.5mol,配制过程中硫酸的物质的量不变,则需要18.4mol/L的浓硫酸的体积为:0.5mol÷18.4mol/L≈0.02717L=27.2mL,因此需要50mL量筒。配制溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,需要的仪器为:量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,所以不需要的是BDE;(3)根据以上分析可知还缺少的仪器为250mL容量瓶和胶头滴管;(4)根据以上分析可知需要浓硫酸的体积是27.2mL;(5)根据以上分析可知正确的操作顺序为CDAGBFE;(6)①容量瓶未干燥,有少量蒸馏水,不会影响;②定容时若仰视刻度线,液面在刻度线上方,则所配溶液的浓度偏低;③量取浓硫酸时若俯视刻度线,量取的浓硫酸体积减少,则所配溶液的浓度偏低;④摇匀后,发现液面低于刻度线,再加水至刻度线,溶液体积增加,浓度偏低。
;(2)没有240mL容量瓶,需要配制250mL溶液,需要硫酸的物质的量为:2.0mol/L×0.25L=0.5mol,配制过程中硫酸的物质的量不变,则需要18.4mol/L的浓硫酸的体积为:0.5mol÷18.4mol/L≈0.02717L=27.2mL,因此需要50mL量筒。配制溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶、贴标签,需要的仪器为:量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,所以不需要的是BDE;(3)根据以上分析可知还缺少的仪器为250mL容量瓶和胶头滴管;(4)根据以上分析可知需要浓硫酸的体积是27.2mL;(5)根据以上分析可知正确的操作顺序为CDAGBFE;(6)①容量瓶未干燥,有少量蒸馏水,不会影响;②定容时若仰视刻度线,液面在刻度线上方,则所配溶液的浓度偏低;③量取浓硫酸时若俯视刻度线,量取的浓硫酸体积减少,则所配溶液的浓度偏低;④摇匀后,发现液面低于刻度线,再加水至刻度线,溶液体积增加,浓度偏低。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列事实能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的盐酸
B.钢铁在潮湿的环境中容易生锈
C.工业合成氨时使用铁触媒为催化剂
D.碳跟氧气反应的实验中增加O2的量可以减少CO的生成
-
科目: 来源: 题型:
查看答案和解析>>【题目】完成下列计算:
(1)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)相同质量的SO2、SO3的氧原子的个数之比为___________。
(3)1/28 mol N2含有a个N原子,则阿伏加德罗常数可以表示为___________mol-1。
(4)4.6g Na单质变成Na+,会失去__________mol的电子
(5)已知VmL的Fe2(SO4)3溶液中含SO42- a g,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(16分)
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
ⅰ
3
产生大量白色沉淀;溶液呈红色
ⅱ
30
产生白色沉淀;较3 min时量少;溶液红色较3 min时加深
ⅲ
120
产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(13分)
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
69
25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
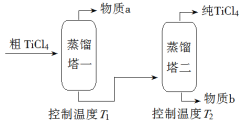
物质a是______________,T2应控制在_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某有机物A的结构简式为
 ,请回答下列问题:
,请回答下列问题:(1)A中含氧官能团的名称是____;
(2)A可能发生的反应有_____(填序号);
①酯化反应 ②加成反应 ③消去反应 ④水解反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】[2016上海]NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×1010)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________________(选填“酸性”、“碱性”或“中性”);原因是______________________________。
(2)写出第二次氧化时发生反应的离子方程式:_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___________g(实际用量应为理论值的4倍,才能使NaCN含量低于0.5 mg/L,达到排放标准)。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”、“非极性”)。HClO的电子式为___________。
相关试题

