【题目】完成下列计算:
(1)0.3 mol NH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)相同质量的SO2、SO3的氧原子的个数之比为___________。
(3)1/28 mol N2含有a个N原子,则阿伏加德罗常数可以表示为___________mol-1。
(4)4.6g Na单质变成Na+,会失去__________mol的电子
(5)已知VmL的Fe2(SO4)3溶液中含SO42- a g,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为______________。
参考答案:
【答案】 0.4NA或2.408×1023 5:6 14a 0.2 125a/288V
【解析】(1)0.3 mol NH3分子中所含原子的物质的量是0.3mol×4=1.2mol,因此含有相同原子数的水分子的物质的量是1.2mol÷3=0.4mol,个数是0.4NA。(2)相同质量的SO2、SO3的氧原子的个数之比为![]() =5:6。(3)1/28 mol N2含有a个N原子,氮原子的物质的量是
=5:6。(3)1/28 mol N2含有a个N原子,氮原子的物质的量是![]() ,则
,则![]() ,即阿伏加德罗常数可以表示为14amol-1。(4)4.6g Na的物质的量是4.6g÷23g/mol=0.2mol,单质变成Na+,会失去0.2mol的电子;(5)硫酸根的物质的量是
,即阿伏加德罗常数可以表示为14amol-1。(4)4.6g Na的物质的量是4.6g÷23g/mol=0.2mol,单质变成Na+,会失去0.2mol的电子;(5)硫酸根的物质的量是![]() ,根据化学式可知铁离子的物质的量是
,根据化学式可知铁离子的物质的量是![]() ,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为
,取0.25VmL该溶液稀释至4VmL,则稀释后溶液中Fe3+的物质的量浓度为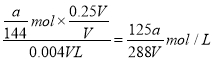 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下柠檬水溶液的pH是3,其中的c(OH-)是( )
A.0.1 mol/LB.1×10-3 mol/LC.1×10-11 mol/LD.1×10-7 mol/L
-
科目: 来源: 题型:
查看答案和解析>>【题目】将少量饱和FeCl3溶液分别滴加到下列物质中,得到三种分散系,完成相关问题:
甲:饱和FeCl3溶液滴加到冷水中;
乙:饱和FeCl3溶液滴加到NaOH溶液中;
丙:饱和FeCl3溶液滴加到沸水中。
(1)将丙继续加热煮沸到液体呈红褐色,反应的化学方程式为________________________。
(2)如何用最简单的方法判断丙中是否成功制备胶体?_________________________。
(3)向经过检验后的丙中逐渐加入稀盐酸,会出现一系列变化:
①先出现和乙中相同的现象,原因为________________________。
②随后发生变化得到和甲相同的溶液,此反应的离子反应方程式为_____________________。
(4)向丙中加入电极通电后,Fe(OH)3胶体粒子应该移向_______极,说明该胶体粒子带_____电;提纯Fe(OH)3胶体中混有的少量离子可以用的方法是_______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列事实能用勒夏特列原理解释的是
A.配制FeCl3溶液时加入少量的盐酸
B.钢铁在潮湿的环境中容易生锈
C.工业合成氨时使用铁触媒为催化剂
D.碳跟氧气反应的实验中增加O2的量可以减少CO的生成
-
科目: 来源: 题型:
查看答案和解析>>【题目】(16分)
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
ⅰ
3
产生大量白色沉淀;溶液呈红色
ⅱ
30
产生白色沉淀;较3 min时量少;溶液红色较3 min时加深
ⅲ
120
产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为实验室某浓硫酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
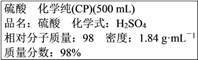
(1)通过计算可知,上述浓硫酸中H2SO4的物质的量浓度为__________molL-1。
实验室需要240 mL 2.0 mol·L-1的H2SO4溶液,现用以上浓硫酸配制,请回答下列问题:
(2)下列仪器中,不会用到的是________。
A.50 mL量筒 B.100 mL容量瓶 C.玻璃棒 D.托盘天平 E.药匙 F.烧杯
(3)若要实施配制,除上述仪器外,还缺少的仪器为________。
(4)请先通过计算____(请把计算过程写在框内),再确定量取________mL浓硫酸溶液用于稀释。

(5)配制过程简述为以下各步,其正确的操作顺序为_________________(填各步骤序号)。
A.冷却至室温 B.洗涤并移液 C.量取 D.稀释 E.摇匀装瓶 F.定容 G.移液
(6)在配制过程中,下列情况对配制结果有何影响?(填“偏高”“偏低”或“无影响”)
①容量瓶未干燥,有少量蒸馏水,则所配溶液的浓度________;
②定容时若仰视刻度线,则所配溶液的浓度________;
③量取浓硫酸时若俯视刻度线,则所配溶液的浓度________;
④摇匀后,发现液面低于刻度线,再加水至刻度线________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(13分)
TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:

资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
69
25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:_______________________。
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
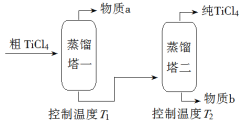
物质a是______________,T2应控制在_________。
相关试题

