【题目】(1)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是____________。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
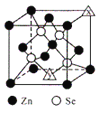
(3)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
参考答案:
【答案】Fe3+的3d5半满状态更稳定 N2O(或CO2、CS2、OCN-)2∶3异硫氰酸分子间存在氢键Zn正四面体50%![]() ×107
×107
【解析】
(1)从结构角度来看,Fe2+的价电子排布式是:3d6,再失一个电子就是3d5半充满稳定结构,故易被氧化成Fe3+;
(2)①与SCN-互为等电子体的一种微粒是:N2O(或CO2、CS2、OCN-);②硫氰酸(H-S-C≡N)中π键和σ键的个数之比为2∶3;③异硫氰酸分子间可以形成氢键,故其沸点比硫氰酸沸点高;
(3)硒化锌的晶胞结构中X和Y点所堆积的原子均为Zn,该晶胞中四个硒原子所处晶胞体对角线四分之一处,空隙类型为正四面体,但只占据了其中4个位置,故该种空隙的填充率为50%;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a为![]() ×107nm。
×107nm。
-
科目: 来源: 题型:
查看答案和解析>>【题目】反应4A(s)+3B(g)=2C(g)+D(g),经2min B的浓度减少0.6 mol/L。有关反应速率的说法正确的是
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 分别用A、B、C、D表示反应的速率,其比值是4:3:2:1
C. 2 min内的反应速率,用B表示是0.3 mol/(L·min)
D. 在这2 min内用B和C表示的反应速率的值都是逐渐减小的
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1反应Ⅱ:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2反应Ⅲ:CO(g)+2H2(g)
 CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1回答下列问题:
(1)反应Ⅱ的△H2=______________。
(2)反应Ⅲ能够自发进行的条件是__ (填“较低温度”、“ 较高温度”或“任何温度”)
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是________。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1:3:1:1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是____。
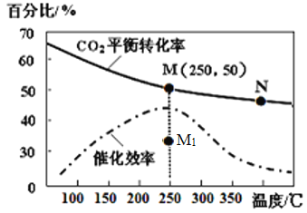
A.其他条件不变,若不使用催化剂,则250℃时CO2的平衡转化率可能位于M1
B.温度低于250℃时,随温度升高甲醇的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1L密闭容器中充入3molH2和1molCO2发生反应Ⅰ,250℃时反应的平衡常数K=__________;若要进一步提高甲醇积分数。可采取的措施有________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在恒温、恒容的密闭容器中发生反应A(g)
 B(g)+C(g)(反应热量因素忽略)。若反应物的浓度由1.8mol/L降到1mol/L需30s,那么反应物浓度由1mol/L降到0.6mol/L所需的时间为
B(g)+C(g)(反应热量因素忽略)。若反应物的浓度由1.8mol/L降到1mol/L需30s,那么反应物浓度由1mol/L降到0.6mol/L所需的时间为A. 15s B. 大于15s C. 小于15s D. 无法判断
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图所示为密闭容器中反应C+H2O(g)
 CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是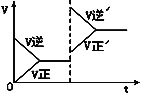
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 改变的条件是增大压强
D. 新平衡时CO的浓度比原平衡小
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50mL1mol/L的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
A. 75mL3mol/L的NH4Cl B. 150mL1mol/L的NaCl
C. 50mL1.5mol/L的CaCl2 D. 50mL3mol/L的NaClO
相关试题

