【题目】如图所示为密闭容器中反应C+H2O(g)![]() CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
CO+H2 ΔH>0达到平衡后,由于条件改变而引起正、逆反应速率的变化以及平衡移动的情况。下列说法错误的是
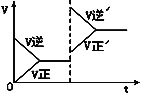
A. 起始反应物为CO和H2
B. 改变条件后平衡逆向移动
C. 改变的条件是增大压强
D. 新平衡时CO的浓度比原平衡小
参考答案:
【答案】D
【解析】A. 根据图像,起始时,逆反应速率大于正反应速率,且正反应速率为0,说明起始反应物为CO和H2,故A正确;B.根据图像, 改变条件后,逆反应速率大于正反应速率,平衡逆向移动,故B正确;C. 改变的条件后,逆反应速率和正反应速率均增大,且逆反应速率大于正反应速率,增大压强,平衡逆向移动,逆反应速率大于正反应速率,与图像吻合,故C正确;D.根据C的分析,改变的条件是增大压强,体积减小,新平衡时CO的浓度比原平衡大,故D错误;故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称“三盐”,白色或微黄色粉末,热稳定性能优良,主要用作聚氯乙烯的热稳定剂。“三盐”是由可溶性铅盐中加入硫酸生成硫酸铅,再加氢氧化钠而制得。以100.0吨铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示

已知:(1)Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13;
(2)铅与冷盐酸、冷硫酸几乎不起作用。
请回答下列问题:
(1)写出步骤①“转化”的化学方程式_________________________________
(2)步骤②“过滤1”后所得滤渣的主要成分为_____________
(3)步骤③“酸溶”,最适合选用的酸为___________,为提高酸溶速率,可采取的措施是____________________________________(任意写出一条)
(4)若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5mol·L-1,则此时c(SO42-)=_________ mol·L-1
(5)从原子利用率的角度分析该流程的优点为____________________________________。
(6)步骤⑥“合成”三盐的化学方程式为____________________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是____________。
(2)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
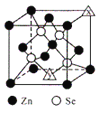
(3)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在恒温、恒容的密闭容器中发生反应A(g)
 B(g)+C(g)(反应热量因素忽略)。若反应物的浓度由1.8mol/L降到1mol/L需30s,那么反应物浓度由1mol/L降到0.6mol/L所需的时间为
B(g)+C(g)(反应热量因素忽略)。若反应物的浓度由1.8mol/L降到1mol/L需30s,那么反应物浓度由1mol/L降到0.6mol/L所需的时间为A. 15s B. 大于15s C. 小于15s D. 无法判断
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列溶液中Cl-的物质的量浓度和Cl-的物质的量与50mL1mol/L的AlCl3溶液中Cl-物质的量浓度和Cl-的物质的量都相等的是
A. 75mL3mol/L的NH4Cl B. 150mL1mol/L的NaCl
C. 50mL1.5mol/L的CaCl2 D. 50mL3mol/L的NaClO
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质
甘氨酸(NH2CH2COOH)
柠檬酸
甘氨酸亚铁
易溶于水,微溶于乙醇,
两性化合物
易溶于水和乙醇,有强酸性
和还原性
易溶于水,
难溶于乙醇
实验过程:Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:将配制好的绿矾溶液与200mL 1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)实验I中:实验室配制绿矾溶液,将铁粉与稀硫酸混合时哪种试剂应该过量_______
(2)实验II中:制备FeCO3时应向_______溶液中缓慢加入________溶液边加边搅拌,若颠倒试剂滴加顺序可能产生的后果是__________________生成沉淀的离子方程式为________________
(3)确认C中空气排尽的实验现象是______________
(4)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________
(5)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
(6)若产品的质量为17.34g,则产率为________%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入1molN2,右边充入一定量的CO时,隔板处于如图位置(保持温度不变),下列说法正确的是( )

A.右边与左边分子数之比为4:1
B.右侧CO的质量为5.6 g
C.右侧气体密度是相同条件下氢气密度的14倍
D.若改变右边CO的充入量而使隔板处于容器正中间,保持温度不变,则应充入22.4 L的CO
相关试题

