【题目】常温下,在pH=l的某溶液中可能含有Na+、Fe3+、Fe2+、CO32-、Cl-、I-中的某几种,现取100 mL该溶液进行如下实验:
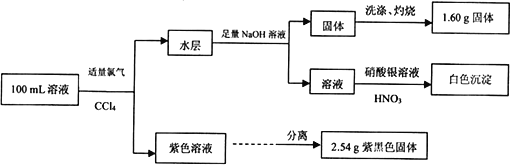
根据实验结果,下列有关原溶液的说法正确的是
A. 溶液中Fe2+与I-的物质的量浓度相等
B. 不能确定Na+和Cl-是否存在,CO32-一定不存在
C. 溶液中Fe3+与Fe2+至少有一种
D. 溶液中 c(Cl-)≥0.2 mol·L-1
参考答案:
【答案】A
【解析】溶液中通入氯气,得到紫红色溶液,说明原溶液含有I-,不含Fe3+;紫黑色固体是碘,2.54g碘的物质的量是0.01mol,原溶液含有I- 0.02mol,水层加入氢氧化钠溶液有固体生成,说明原溶液一定有Fe2+,一定不含CO32-;根据灼烧后得到氧化铁的质量可计算原溶液一定有Fe2+的物质的量为0.02mol;通入氯气的溶液中加入硝酸银生成白色沉淀,不能证明原溶液是否含有Cl-;pH=l说明氢离子的浓度是0.1mol/L,氢离子的物质的量是0.01mol;根据以上分析,溶液中Fe2+与I-的物质的量浓度相等,故A正确;根据电荷守恒,溶液中一定含有Cl-,故B错误;溶液中一定没有Fe3+,一定有Fe2+,故C错误;根据电荷守恒,若溶液中不含Na+,则 c(Cl-)=0.3 mol·L-1,若含有Na+,则 c(Cl-)>0.3 mol·L-1,故D错误。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室需要配制0.50 mol/L NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。①天平调平之后,应将天平的游码调至某个位置
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是________________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了___________________。定容,摇匀。将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(6)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会__________(填“偏高”、“偏低”或“无影响”)。

-
科目: 来源: 题型:
查看答案和解析>>【题目】镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A. Li2SO4能溶于水
B. LiOH是易溶于水、受热不分解的强碱
C. Li遇浓硫酸不产生“钝化”现象
D. Li2CO3受热分解,生成Li2O和CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)
 Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是A. c(Ba2+)增大
B. 溶液中Ba2+数目减少
C. 溶液pH减小
D. 溶液质量增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】A为ⅡA主族元素,B为ⅢA主族元素,A、B同周期,其原子序数分别为M,N,甲乙为同一主族相邻元素,其原子序数分别为X、Y。则下列选项中的两个关系式均正确的是:
A. N=M+10 Y=X+2 B. N=M+11 Y=X+4 C. N=M+25 Y=X+8 D. N=M+10 Y=X+18
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是( )
A.自发进行的反应一定是放热反应
B.非自发进行的反应一定不能发生
C.自发进行的反应一定能发生
D.有些吸热反应也能自发进行
-
科目: 来源: 题型:
查看答案和解析>>【题目】在可逆反应中,改变下列条件一定能加快反应速率的是( )
①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大体积
A.全部B.①②C.①②③D.①②③④
相关试题

