【题目】实验室需要配制0.50 mol/L NaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。①天平调平之后,应将天平的游码调至某个位置
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是________________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了___________________。定容,摇匀。将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(6)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会__________(填“偏高”、“偏低”或“无影响”)。

参考答案:
【答案】 500ml容量瓶 量筒 14.6 左盘 搅拌,加速溶解 玻璃棒 使所有溶质都转移到容量瓶中 偏低
【解析】本题主要考查一定物质的量浓度溶液的配制方法。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、500ml容量瓶、量筒以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体NaCl晶体0.50mol/L×0.5L×58.5g/mol=14.6g。
(3)称量。
②称量过程中NaCl晶体应放于天平的左盘。
③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却。该步实验中需要使用玻璃棒,目的是搅拌,加速溶解。
(5)转移、洗涤。在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了使所有溶质都转移到容量瓶中。定容,摇匀。将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(6)仰视使溶液体积变大,所配溶液的浓度会偏低。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各项中,不属于水质检测项目的是 ( )
A. pH B. 氧气的溶解度 C. 固体悬浮物 D. 有毒、有害物浓度
-
科目: 来源: 题型:
查看答案和解析>>【题目】硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgOB2O3H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如图:

已知:i.Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2、9.7和12.4.
ⅱ.H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g.
(1)为了提高硼镁矿粉的浸出率,可采取的措施有___________(至少答两条).
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42﹣,还含有Fe3+、Fe2+、Ca2+、Al3+等杂质.“除杂”时向浸出液中依次加入适量H2O2和MgO,H2O2的作用是_______________________ (用离子方程式表示),MgO除去的杂质离子是____________________.
(3)已知H3BO3与过量的NaOH反应生成Na[B(OH)4],试写出H3BO3在溶液中的电离方程式_______________________.
(4)“浸取”后,采用“热过滤”的目的是______________,母液中的主要溶质有___________、___________(主要由两种).
(5)测定所得产品的纯度:取a g硼酸,小心加热使其分解脱去水分(杂质受热不分解),得残留固体b g,则产品的纯度为__________________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见下图,下列说法正确的是

A. 正极电极反应式为O2+2H2O+4e-=4OH-
B. CO32-向负极移动
C. a为CH4,b为CO2
D. 此电池在常温时也能工作
-
科目: 来源: 题型:
查看答案和解析>>【题目】镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
A. Li2SO4能溶于水
B. LiOH是易溶于水、受热不分解的强碱
C. Li遇浓硫酸不产生“钝化”现象
D. Li2CO3受热分解,生成Li2O和CO2
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,在Ba(OH)2的悬浊液中,存在Ba(OH)2固体与其电离的离子间的溶解平衡关系:Ba(OH)2(s)
 Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是
Ba2+(aq)+2OH-(aq),向此体系中再加入少量的BaO粉末,如果保持温度不变,则下列说法正确的是A. c(Ba2+)增大
B. 溶液中Ba2+数目减少
C. 溶液pH减小
D. 溶液质量增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下,在pH=l的某溶液中可能含有Na+、Fe3+、Fe2+、CO32-、Cl-、I-中的某几种,现取100 mL该溶液进行如下实验:
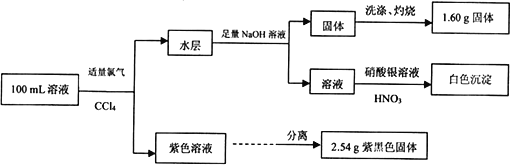
根据实验结果,下列有关原溶液的说法正确的是
A. 溶液中Fe2+与I-的物质的量浓度相等
B. 不能确定Na+和Cl-是否存在,CO32-一定不存在
C. 溶液中Fe3+与Fe2+至少有一种
D. 溶液中 c(Cl-)≥0.2 mol·L-1
相关试题

