
【题目】某种浓差电池的装置如图所示,碱液室中加入电石渣浆液[主要成分为Ca(OH)2],酸液室通入CO2(以NaCl为支持电解质),产生电能的同时可生产纯碱等物质。下列叙述错误的是
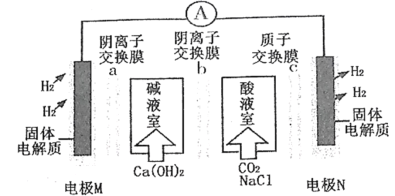
A.电子由电极M经外电路流向电极N
B.在碱液室可以生成NaHCO3、Na2CO3
C.放电一段时间后,酸液室溶液pH减小,碱液室pH增大
D.Cl-通过阴离子交换膜b移向碱液室,H+通过质子交换膜c移向N极
【答案】BC
【解析】
图分析可知N电极区的电极反应式为2H++2e-=H2↑,说明N电池为正极,M电池为负极,碱液室中氢氧根离子通过阴离子交换膜中和正电荷,酸液室中的氢离子通过质子交换膜在电极N表面得到电子生成氢气同时酸液室中的氯离子通过阴离子交换膜加入碱液室补充负电荷,据此分析判断。
A.图分析可知电极M区的电极反应式为H2-2e-=2H+,N电极区的电极反应式为2H++2e-=H2↑,故M为负极,N为正极,故电子由电极M经外电路流向电极N,A正确;
B.放电一段时间后,酸液室氢离子被消耗,最终得到NaHCO3、Na2CO3溶液,在酸液室可以生成NaHCO3、Na2CO3,B错误;
C.放电一段时间后,酸液室氢离子被消耗,酸液室溶液pH增大,碱液室不断产生H+,故pH 减小,C错误;
D.根据上述分析可知:Cl-通过阴离子交换膜b移向碱液室,H+通过质子交换膜c移向N极,D正确;
故答案为:BC。


科目:高中化学 来源: 题型:
【题目】甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:

下列说法正确的是( )
A.N为正极,发生氧化反应
B.a为氧气,b为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的不同主族的短周期元素。X的最高正价与最低负价代数和为0,Y为金属元素,Y与Z最外层电子数之和与W的最外层电子数相等,X与W所在族序数之和等于10。下列说法正确的是
A.简单氢化物的热稳定性:Z>W>X
B.Z、W的简单气态氢化物中心原子的杂化方式不相同
C.XW2分子的空间构型为直线型
D.Z的最高价含氧酸的钠盐溶液中有三种含Z元素的微粒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国家有色金属工业“十三五”发展规划要求,再生铅占铅总量比重到2020年升至45%。从废旧铅蓄电池中回收的工艺流程为![]() ,电解原理如图所示。下列说法错误的是
,电解原理如图所示。下列说法错误的是
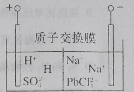
A.电解过程中阳极附近pH明显增大
B.阴极电极反应式为![]() +2e-=Pb+4Cl-
+2e-=Pb+4Cl-
C.电路中通过2 mol电子,阴极可得207 g铅
D.Na2PbCl4浓度下降后,在阴极区加入PbO,可实现电解质溶液的再生使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空容器中充入2molSO2和1molO2,发生反应2SO2(g)+O2(g)![]() 2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
2SO3(g),在一定条件下达到平衡时,SO2的转化率为85%。若在同一容器中,在相同温度下向容器中充入SO3,欲使达到平衡时,各成分的体积分数与上述平衡相同,则起始时SO3的物质的量和达到平衡时SO3的转化率为( )
A.2mol85%B.1mol42.5%C.2mol15%D.1mol30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的![]() 可转化为
可转化为![]() ,该反应分两步反应:
,该反应分两步反应:
I:2![]() +(aq)+3O2(g)=2
+(aq)+3O2(g)=2![]() (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2![]() (aq)+O2(g)=2
(aq)+O2(g)=2![]() (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的![]() (aq)氧化生成
(aq)氧化生成![]() (aq)的热化学方程式为_____。
(aq)的热化学方程式为_____。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___(填字母)。
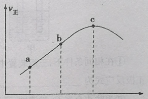
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于水煤气变换反应CO(g)+H2O![]() CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
CO2(g)+H2(g)(简称WGS),目前普遍接受的表面氧化还原机理的可能基元反应步骤如下:
①H2O+*![]() H2O* ②H2O*+*
H2O* ②H2O*+*![]() OH*+H* ③OH*+*
OH*+H* ③OH*+*![]() O*+H* ④2H*+*
O*+H* ④2H*+*![]() H2+2*
H2+2*
⑤CO+*![]() CO* ⑥CO*+O*
CO* ⑥CO*+O*![]() CO2*+* ⑦CO2*
CO2*+* ⑦CO2*![]() CO2+*
CO2+*
其中*表示催化剂表面活性位,X*表示金属表面吸附物种。
表1 WGS反应中可能基元反应步骤的活化能数值(单位:kJ·mol-1)
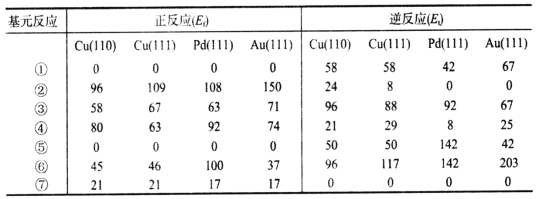
注:表中X(111)表示不同金属的同一晶面,110与111表示不同晶面。
(1)分析表中数据,该机理中WGS反应的速率控制步骤是___________(填序号)。
(2)由表中数据可计算Cu(111)催化WGS反应的焓变△H=____kJ·mol-1。
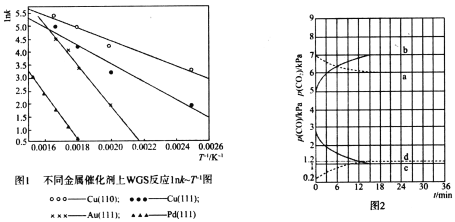
(3)WGS反应的速率表达式:V正=k正·c(CO)·c(H2O),v逆=k逆·c(CO2)·c(H2)(k正、k逆为化学反应速率常数,只与温度有关)。图1是反应速率常数的自然对数与温度倒数的关系图像。由图1可判断550K~600K温度范围内,四种催化剂中活性最好的是_______________。
(4)已知T1时WGS反应的KP=18。温度分别为T2、T3(已知T1>T2>T3)时WGS反应中CO和CO2分压随时间变化关系如图2所示,催化剂为Au(111),实验初始时体系中的p(H2O)和p(CO)相等,p(CO2)和p(H2)相等。则T2时,表示p(CO)、p(CO2)的曲线分别是_________、_________;T2、T3时WGS反应的KP分别为______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数,下述正确的是( )
A.64gSO2含有硫原子数为2NA
B.NA个氧气分子和NA个氢气分子的质量比等于16∶1
C.28g氮气所含的原子数目为NA
D.标准状况下,22.4L的水含有 NA个水分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有0.6molCl-、0.8molSO42-及一定量Mg2+和Al3+的混合溶液中,滴入一定浓度NaOH溶液,产生沉淀情况如图(不考虑Mg2+和Al3+水解及水电离对离子数目的影响)。若反应前Al3+的物质的量为amol,Al3+的物质的量与混合溶液中离子总物质的量的比值为x。则( )

A.若B点横坐标为200mL时,c(NaOH)=7.0mol/L
B.x的取值范围是0<x<![]()
C.A点横坐标的值随x发生变化
D.x=![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com