【题目】氮及其化合物与人们的生活、生产密切相关。回答下列问题:
(1)微生物作用下,废水中的![]() 可转化为
可转化为![]() ,该反应分两步反应:
,该反应分两步反应:
I:2![]() +(aq)+3O2(g)=2
+(aq)+3O2(g)=2![]() (aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
(aq)+4H+(aq)+2H2O(l) △H=-546 kJ·mol-1
II:2![]() (aq)+O2(g)=2
(aq)+O2(g)=2![]() (aq) △H=-146 kJ·mol-1
(aq) △H=-146 kJ·mol-1
则低浓度氨氮废水中的![]() (aq)氧化生成
(aq)氧化生成![]() (aq)的热化学方程式为_____。
(aq)的热化学方程式为_____。
(2)在容积固定的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。
2NO2(g) △H,随温度升高,混合气体的颜色变深。
①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
2NO2(g)的平衡常数Kp=____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。若温度升高,Kp值将_____(填“增大”、“减小”或“不变”)。
②温度T时反应达平衡后,将反应容器的容积减少一半。平衡向____(填“正反应”或“逆反应”)方向移动,判断理由是____。
③向绝热密闭容器中通入一定量的NO2,某时间段内正反应速率随时间的变化如图所示。下列说法正确的是___(填字母)。
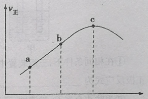
A.逆反应速率:a点小于点c
B.反应在c点达到平衡状态
C.反应物浓度:a点小于b点
【答案】![]() (aq)+2O2(g)=2H+(aq)+H2O(l)+
(aq)+2O2(g)=2H+(aq)+H2O(l)+![]() (aq) H=-346kJ·mol-1
(aq) H=-346kJ·mol-1 ![]() Pa 增大 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动 A
Pa 增大 逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动 A
【解析】
(1)由盖斯定律计算△H;
(2) ①根据平衡常数Kp进行求算;根据平衡移动原理进行分析;
②对气体分子数增大的反应,增大压强平衡向逆反应方向移动;
③反应过程中正反应速率先加快后减少,反应速率先加快说明反应放热,温度升高,速率加快。
(1)由盖斯定律可知,(I+Ⅱ)![]() 可得反应NH4+(aq)+2O2(g)=2H+(aq)+H2 O(1)+NO3-(aq),则△H=[(-546 kJ/mol)+( -146 kJ/mol)]
可得反应NH4+(aq)+2O2(g)=2H+(aq)+H2 O(1)+NO3-(aq),则△H=[(-546 kJ/mol)+( -146 kJ/mol)]![]() =—346 kJ/mol;
=—346 kJ/mol;
(2) ①温度T时反应达平衡,混合气体平衡总压强为p Pa,N2O4气体的平衡转化率为75%,则反应N2O4(g)![]() 2NO2(g)后两物质的量之比为(1-75%):75%
2NO2(g)后两物质的量之比为(1-75%):75%![]() 2=1:6;平衡常数Kp=
2=1:6;平衡常数Kp=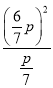 =
=![]() Pa;反应N2O4(g)
Pa;反应N2O4(g)![]() 2NO2(g)为吸热反应,若温度升高,平衡正向移动,Kp值将增大;
2NO2(g)为吸热反应,若温度升高,平衡正向移动,Kp值将增大;
②温度T时反应达平衡后,将反应容器的容积减少一半,压强增大,平衡向气体体积缩小的逆反应方向移动,判断理由是对气体分子数增大的反应,增大压强平衡向逆反应方向移动;
③反应过程中正反应速率先加快后减少,先反应速率加快说明反应放热,温度升高,速率加快;后反应速率减少是因为反应物浓度减小。
A.随着反应进行逆反应速率逐渐增大,逆反应速率:a点小于c点,选项A正确;
B.c点不是平衡点,二氧化硫转化率不是最大,选项B错误;
C.随着反应进行,反应物浓度减小,选项C错误;
答案选A。

