【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 15g乙烷分子中含有共价键的数目为3NA
B. 常温常压下,7g乙烯、丙烯的混合物含有原子数为1.5NA
C. 0.1mol/L的AlCl3溶液中含有的铝离子数为0.01NA
D. 25℃时,1L0.1mol/L的CH3COOH溶液中的H+数为0.1NA
参考答案:
【答案】B
【解析】
A. 15g乙烷的物质的量为![]() = 0.5mol,乙烷的式:C2H6,,每个分子中含有共价键的数目为7NA,所以15g乙烷分子中含有共价键的数目为:0.5mol
= 0.5mol,乙烷的式:C2H6,,每个分子中含有共价键的数目为7NA,所以15g乙烷分子中含有共价键的数目为:0.5mol![]() =3.5NA,故A错;B. 乙烯、丙烯最简式为 CH2常温常压下,7g 的混合物含有原子数为
=3.5NA,故A错;B. 乙烯、丙烯最简式为 CH2常温常压下,7g 的混合物含有原子数为![]() 1.5NA.故B正确;C.没有告诉
1.5NA.故B正确;C.没有告诉![]() 的
的![]() 溶液的体积,无法计算溶液中氯离子的物质的量及数目,故C错误;
溶液的体积,无法计算溶液中氯离子的物质的量及数目,故C错误;![]()
![]() 的
的![]() 溶液中含有溶质醋
溶液中含有溶质醋![]() ,因为醋酸为弱酸,所以
,因为醋酸为弱酸,所以![]() 醋酸电离出的氢离子小于
醋酸电离出的氢离子小于![]() ,溶液中的
,溶液中的![]() 数小于
数小于![]() ,故D错误;所以B选项是正确的。
,故D错误;所以B选项是正确的。
-
科目: 来源: 题型:
查看答案和解析>>【题目】“新时代”的中学生应具备一定的化学科学素养。下列描述中,不符合化学基本原理的是
A. 电解熔融的氧化铝制取金属铝,不能用铁作阳极
B. 垃圾是污染物,一定条件下还可能产生二次污染
C. 向铁中添加一定比例的铜制成合金,防止铁制品被腐蚀
D. 治理雾霾的根本方法是从源头上控制形成雾霾的污染物
-
科目: 来源: 题型:
查看答案和解析>>【题目】由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):

已知:I.

II.

回答下列问题:
(1)反应②的类型是_______。
(2)D的结构简式是_______。
(3)G中含有的官能团的名称是_______。
(4)E与足量NaOH溶液反应的化学方程式是_______。
(5)设计C→D和E→F两步反应的共同目的是_______。
(6)化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式_______。
(7)已知
 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物 的合成路线_____________________(其他试剂任选)。
的合成路线_____________________(其他试剂任选)。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于纯净物、混合物、强电解质、弱电解质和非电解质的组合正确的是
组合
纯净物
混合物
强电解质
弱电解质
非电解质
A
氨水
食盐水
硫酸
醋酸
干冰
B
氧化铁
家用食醋
硫酸钡
碳酸
蔗糖
C
胆矾
碘酒
苛性钠
碳酸
碳酸钙
D
盐酸
氯化钾溶液
氯化钠
氢氧化铜
氢气
A.AB.BC.CD.D
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中官能团名称不正确的是
A.乙烯(碳碳双键)B.乙醇(羟基)
C.乙酸(羧基)D.乙酸乙酯(脂基)
-
科目: 来源: 题型:
查看答案和解析>>【题目】研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:
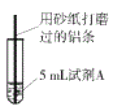
实验序号
试剂A
实验现象
1
0.2mol/LCuCl2溶液
铝条表面有气泡产生,并有红色固体析出
2
0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体
开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出
3
2mol/LCuSO4溶液
铝条表面有少量气泡产生,并有少量红色固体
4
2mol/LCuCl2溶液
反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成
(1)实验1中,铝条表面析出红色固体的反应的离子方程式为_________。
(2)实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为______g。
(3)实验3的目的是_________ 。
(4)经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
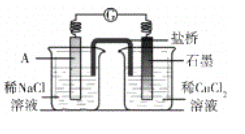
①A极的电极材料是_________。
②能证明该反应发生的实验现象是_________ 。
(5)为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:
实验序号
实验操作
实验现象
i
加入浓NaCl溶液
沉淀溶解,形成无色溶液
ii
加入饱和AlCl3溶液
沉淀溶解,形成褐色溶液
iii
向i所得溶液中加入2mol/LCuCl2溶液
溶液由无色变为褐色
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]
-络离子,用水稀释含[CuCl2]-的溶液时会重新析出CuCl沉淀。 ①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与_____作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]-,应补充的实验是_______。
(6)上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与______有关。
-
科目: 来源: 题型:
查看答案和解析>>【题目】按要求填空:
(1)实验室用加热二氧化锰和浓盐酸制氯气,离子方程式为____________________。若生成标准状况下2.24 L Cl2,则被氧化的HCl的物质的量为 _______________。
(2)向淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,反应的离子方程式为_______________________________________。
(3)①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4 ⑦次氯酸
以上物质中属于电解质的是(填序号)_____________________________________。
(4)在甲、乙两个烧杯中,分别含有下列离子中的三种:Cu2+、Na+、H+、SO42-、CO32-、OH-。已知甲烧杯中的溶液呈蓝色,则乙烧杯中的溶液中大量存在的离子是_____________________。
相关试题

