【题目】每到冬季,雾霾天气肆虐京津冀等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
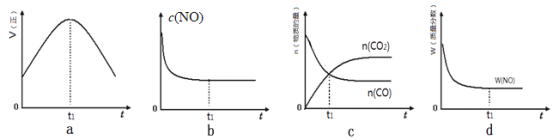
(l)汽车尾气净化的主要原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
2CO2(g)+N2(g)△H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是________________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)![]() N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式__________________。
(3)甲烷燃料电池可以提升能量利用率。
①碱性介质中甲烷燃料电池的负极反应式_________________________。
②如果电路上有0.1mol电子通过,理论上消耗标准状况下氧气的体积为_______。
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比。理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是_________。
参考答案:
【答案】 bd CH4(g)+ N2O4(g)=N2(g)+CO2(g)+2H2O(l)的△H=-898.1 kJ/mol CH4-8e-+10OH-=CO32-+7H2O 0.56L 氢气、甲烷、甲醇
【解析】
(1)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
a.到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,a错误;
b.NO的浓度随着反应的进行逐渐减小,达到化学平衡后NO的浓度不再发生变化,b正确;
c.t1时刻后CO2、CO的物质的量发生变化,t1时刻未到达平衡状态,c错误;
d.t1时刻NO的质量分数为定值,说明NO的浓度、百分含量不再变化,即t1时刻已经达到平衡状态,d正确。
答案选bd;
(2)已知:
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol ①
2NO2(g)![]() N2O4(g) △H=-56.9 kJ/mol ②
N2O4(g) △H=-56.9 kJ/mol ②
H2O(g)=H2O(l) △H=-44.0 kJ/mol ③
根据盖斯定律,①-②+③×2可得反应CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(l)的△H=-898.1 kJ/mol;
(3)①原电池中负极发生氧化反应,甲烷在负极通入,碱性条件下,发生氧化反应生成碳酸根和水,负极电极反应式为CH4-8e-+10OH-=CO32-+7H2O;
②1mol氧气得到4mol电子,如果电路上有0.1mol电子通过,则根据电子得失守恒可知消耗氧气的物质的量是0.1mol÷4=0.025mol,标准状况下氧气的体积为0.025mol×22.4L/mol=0.56L;
(4)已知燃料电池的比能量与单位质量的燃料失去的电子数成正比,如果质量均是1g,则氢气、甲烷、甲醇失去电子的物质的量分别是![]() 、
、![]() 、
、![]() ,所以需要理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是氢气、甲烷、甲醇。
,所以需要理论上,氢气、甲烷、甲醇燃料电池的比能量从大到小的顺序是氢气、甲烷、甲醇。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是( )
A.钠的摩尔质量等于它的相对原子质量
B.CH4的摩尔质量为16 g/mol
C.22.4 L任何气体的物质的量均为1 mol
D.1 mol 任何物质均含有NA个分子 -
科目: 来源: 题型:
查看答案和解析>>【题目】一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(1)硼酸(H3BO3)为一元酸,硼酸中B的化合价为__________________。
(2)已知:Ka(H3BO3)=5.8×10-l0,Ka(H2CO3)=4.4×10-7,Ka(HCO3-)=4.7×10-l1,向饱和硼酸溶液中滴加0.1 molL-1Na2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。写出该反应的化学方程式____________________________________。
(3)以硼酸为原料可制备重要还原剂NaBH4,BH4-的电子式为______________。NaBH4与BF3在50℃~70℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是___________________________。
(4)硫酸溶解铁硼矿可制得含Fe3+、Fe2+、Al3+杂质的硼酸溶液,提纯过程中加入H2O2的目的是____________________,为除去Fe3+、Al3+ (使其浓度均小于1×10-6 mol·L-1),需至少调节pH=_________(已知: Ksp[Al(OH)3]= 1×10-33,Ksp[Fe(OH)3]=4×10-38)
(5)H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
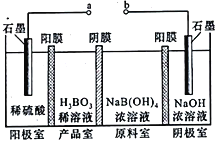
①a接电源的____________ (填“正极”、“ 负极”)
②写出阳极的电极反应式__________________________________。
③原料室中阴、阳离子是如何迁移的?_______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】BaCO3与稀硝酸反应,正确的离子方程式是( )
A.Ba2++CO32﹣+2H+=Ba(NO3)2+H2O+CO2↑
B.BaCO3+2H+=Ba2++H2O+CO2↑
C.BaCO3+2H++2NO3﹣=Ba(NO3)2+H2O+CO2↑
D.CO32﹣+2H+=H2O+CO2↑ -
科目: 来源: 题型:
查看答案和解析>>【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
-
科目: 来源: 题型:
查看答案和解析>>【题目】按下图装置进行实验,并回答下列问题:
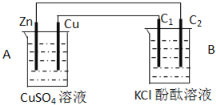
(1)判断装置的名称:A池为_________,B池为___________。
(2)铜极为______极,电极反应式为_________,石墨棒C1为___极,电极反应式为______________________,石墨棒C2附近发生的实验现象为___________________。
(3)当C2极析出224mL气体(标准状态时),锌的质量变化(增加或减少)_____g,CuSO4溶液的质量变化了(增加或减少了)______g。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列化学用语表示正确的是:
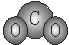
A. CO2分子的球棍模型:
 B. 14N 的原子结构示意图:
B. 14N 的原子结构示意图: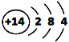
C. CH4分子的比例模型:
 D. 质子数为6,中子数为8 的核素:l4C
D. 质子数为6,中子数为8 的核素:l4C
相关试题

