
【题目】自上个世纪德国建立了第一套合成氨装置,合成氨工业为解决人类的温饱问题作出了极大贡献。回答下列问题:
(1)已知:①1g H2 完全燃烧生成H2O(g)放出121kJ 的热量;
②N2(g) +O2(g)==2NO(g) △H =+180.5kJ·mol-1
③4NH3(g) +5O2(g)==4NO(g) +6H2O(g) △H =-906.2kJ·mol-1
工业合成氨的热化学方程式是_________________________________________。
(2)应用化石燃料(特别是煤)制备的原料气H2 中含有杂质碳( 主要成分为CO2)、杂质硫主要成分为H2S)。工业上采用湿法脱硫的方法回收硫,方法是先用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠( Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式是_________________________,反应中转移2×103mol电子时,理论上回收硫_______kg。
(3)工业上利用NH3为原料合成尿素,其原理是2 NH3(g) +CO2(g)![]() CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
CO(NH2)2(1)+ H2O(g)。①该可逆反应的平衡常数(K)和温度(T)的关系如下:
T/℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
合成尿素的反应为_____________(填“放热反应”或“吸热反应”)。
②合成尿素的原料气中NH3和CO2的物质的量之比称为氨碳比,可用[n(NH3)]/[n(CO2)]表示。在一定温度和压强下,图甲中曲线________(填“I”或“II”)表示的是氨碳比与CO2的转化率(a)的关系,判断理由是_______________________________;当[n(NH3)]/[n(CO2)]=4时,NH3的转化率为_______________。

(4)利用特殊的材料,通过电化学法也可以合成氨,如图乙所示原理可利用N2、H2、CO、水蒸气合成氨。阳极反应式是_______________,离子交换膜中通过的离子是_____(填化学符号)。
【答案】 3H2(g)+N2(g)==2NH3 (g) △H=-92 4kJ/mo1 2NHS+4NaVO3+H2O==Na2V4O9+4NaOH+2S↓ 32 放热反应 I n(NH3)/n(CO2)大,则c(NH3)大,CO2转化率增大 32% H2+CO+H2O-4e-==CO2+4H+ H+
【解析】(1)已知:①1gH2完全燃烧生成H2O(g)放出121kJ的热量,则1mol氢气完全燃烧生成H2O(g)放出242kJ的热量,即H2(g)+![]() O2(g)==H2O(g) △H=-242kJ/mo1;②N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1,③4NH3(g)+5O2(g)==4NO(g)+6H2O(g)△H =-906.2kJ·mol-1,根据盖斯定律,将①×3+②-
O2(g)==H2O(g) △H=-242kJ/mo1;②N2(g)+O2(g)==2NO(g) △H =+180.5kJ·mol-1,③4NH3(g)+5O2(g)==4NO(g)+6H2O(g)△H =-906.2kJ·mol-1,根据盖斯定律,将①×3+②-![]() ×③,得:3H2(g)+N2(g)==2NH3(g) △H=3×(-242kJ/mo1)+(+180.5 kJ/mo1)-
×③,得:3H2(g)+N2(g)==2NH3(g) △H=3×(-242kJ/mo1)+(+180.5 kJ/mo1)-![]() ×(-906.2 kJ/mo1)=-924kJ/mo1,故答案为:3H2(g)+N2(g)==2NH3(g) △H=-924kJ/mo1;
×(-906.2 kJ/mo1)=-924kJ/mo1,故答案为:3H2(g)+N2(g)==2NH3(g) △H=-924kJ/mo1;
(2)用纯碱溶液吸收H2S,使之转化为NaHS,然后用偏钒酸钠(NaVO3)溶液氧化硫元素,使之转化为硫单质,并生成焦钒酸钠(Na2V4O9),混法脱硫中发生的氧化还原反应的化学方程式为2NHS+4NaVO3+H2O==Na2V4O9+4NaOH+2S↓,反应中硫的化合价升高2×2=4,V的化合价降低1×4=4,转移4个电子,因此反应中转移2×103mol电子时,反应生成硫![]() =1000mol,质量为1000mol×32g/mol=32000g=32kg,故答案为:2NHS+4NaVO3+H2O==Na2V4O9+4NaOH+2S↓;32;
=1000mol,质量为1000mol×32g/mol=32000g=32kg,故答案为:2NHS+4NaVO3+H2O==Na2V4O9+4NaOH+2S↓;32;
(3)①根据表格数据,升高温度,平衡常数K减小,说明平衡逆向移动,则正反应为放热反应,故答案为:放热反应;
②根据方程式2 NH3(g)+CO2(g)![]() CO(NH2)2(1)+ H2O(g),随着氨碳比[n(NH3)]/[n(CO2)]增大,氨气的转化率减小,二氧化碳的转化率增大,结合图像可知,曲线I满足条件;当[n(NH3)]/[n(CO2)]=4时,二氧化碳的转化率=64%,假设二氧化碳为1mol,则氨气为4mol,反应的氨气为1mol×64%×2,因此氨气的转化率=
CO(NH2)2(1)+ H2O(g),随着氨碳比[n(NH3)]/[n(CO2)]增大,氨气的转化率减小,二氧化碳的转化率增大,结合图像可知,曲线I满足条件;当[n(NH3)]/[n(CO2)]=4时,二氧化碳的转化率=64%,假设二氧化碳为1mol,则氨气为4mol,反应的氨气为1mol×64%×2,因此氨气的转化率=![]() ×100%=32%,故答案为:I;n(NH3)/n(CO2)大,则c(NH3)大,CO2转化率增大;32%;
×100%=32%,故答案为:I;n(NH3)/n(CO2)大,则c(NH3)大,CO2转化率增大;32%;
(4)可利用N2、H2、CO、水蒸气合成氨,根据示意图,反应中N元素化合价降低发生还原反应,H和C元素化合价升高发生氧化反应,因此阳极反应式为H2+CO+H2O-4e-==CO2+4H+,生成的氢离子需要通过离子交换膜进入阴极区,反应形成氨气放出,故答案为:H2+CO+H2O-4e-==CO2+4H+;H+。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的NH3和CH4两种气体,下列有关说法错误的是
A. 所含分子数之比为16∶17 B. 所含电子数之比为16∶17
C. 所含氢元素的质量之比为17∶16 D. 密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域可以寻找制备新型农药材料的元素,它们是( )
A.左下方区域的金属元素
B.右上方区域的某些非金属元素
C.金属元素和非金属元素分界线附近的元素
D.过渡元素区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z在元素周期表中的位置关系如图,其中X是短周期中原子半径最大的金属元素,Y的单质在常温下为淡黄色固体,下列有关说法正确的是

A. Y的简单氢化物的热稳定性比W、Z的都强
B. 四种元素的简单离子具有相同的电子层结构
C. X的氧化物结构中阴阳离子之比为1:2
D. Y的最高价氧化物对应水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
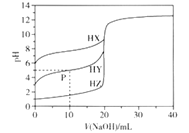
A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度和压强下,1体积X2(g)和3体积Y2(g)化合生成2体积Z(g),则Z气体的化学式是__________。
(2)在标准状况下,CO和CO2的混合气体质量为36 g,体积为22.4 L,则CO所占的体积是_________L,质量是__________g。
(3)N2、CO2、SO2三种气体的物质的量比为1∶2∶1时,它们的原子个数比为_____;质量比为____。
(4)在标准状况下①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小顺序是(填序号)a.体积:___________;b.密度:_____;c.质量:___;d.氢原子个数:________。
(5)将质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为_________,氮原子和氧原子的个数比为___________,该混合气体的平均摩尔质量为______________。
(6)标况下,将224L的HCl气体溶于835mL(ρ=1g/cm3)的水中,所得盐酸的密度为1.2g/cm3,该盐酸的物质的量浓度___________。
(7)某气体物质质量为6.4 g,含有6.02×1022个分子,则该气体的相对分子质量为__________。
(8)相同质量的O2和O3,所含分子数目之比为_________,所含O的物质的量之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO物质的量为10 mol,平衡后CO物质的量为8 mol。下列说法正确的是( )
A. 升高温度,H2S浓度增加,表明该反应是吸热反应
B. CO的平衡转化率为80%
C. 通入CO后,正反应速率逐渐增大
D. 反应前H2S物质的量为7 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com