【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
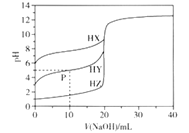
A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
【答案】D
【解析】A.根据图像,0.100 mol/LHX溶液的pH=6,则Ka(HX)=![]() =
=![]() = 10-11,故A错误;B. X-的水解平衡常数Kh=
= 10-11,故A错误;B. X-的水解平衡常数Kh=![]() =
=![]() =10-3>Ka(HX),HX的电离程度小于X-的水解程度,故B错误;C.根据电荷守恒,pH=7时,三种溶液中都存在c(X-) = c1(Na+),c(Y-)= c2(Na+),c(Z-)== c3(Na+),而三种酸的强弱不同,则pH=7时,消耗的氢氧化钠的体积不同,即c1(Na+)≠ c2(Na+)≠ c3(Na+),故C错误;D. P点对应的溶液中存在等浓度的HY和NaY,溶液显酸性,说明以HY的电离为主,则c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-),故D正确;故选D。
=10-3>Ka(HX),HX的电离程度小于X-的水解程度,故B错误;C.根据电荷守恒,pH=7时,三种溶液中都存在c(X-) = c1(Na+),c(Y-)= c2(Na+),c(Z-)== c3(Na+),而三种酸的强弱不同,则pH=7时,消耗的氢氧化钠的体积不同,即c1(Na+)≠ c2(Na+)≠ c3(Na+),故C错误;D. P点对应的溶液中存在等浓度的HY和NaY,溶液显酸性,说明以HY的电离为主,则c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-),故D正确;故选D。

