【题目】氯化铜和氯化亚铜都是重要的化原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜(含杂质Fe)为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)仪器B的名称是________________;B中反应的离子方程式为_______________________________。
(2)装置C中粗铜粉末与气体充分反应时的生成物是______________________(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
①试剂M应当选用___________(填正确答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是____________________。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:________________________。
[制备CuCl固体]
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2,再加热到300℃以上可获得CuCl固体。
(3)将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是__________________。
(4)为测定CuCl固体的产率,进行如下定量分析:
①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固休平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理:CuCl+FeCl3=CuCl2+FeCl2,Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为________________________。
参考答案:
【答案】 圆底烧瓶或烧瓶 MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O CuCl2,FeCl3 c、e 将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物 防止Cu2+(或CuCl2)水解 97%或0.97
Mn2++Cl2↑+2H2O CuCl2,FeCl3 c、e 将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物 防止Cu2+(或CuCl2)水解 97%或0.97
【解析】试题分析:本题以氯化铜晶体和氯化亚铜的工业制备为题材,主要考查Cl2与Fe、Cl2与Cu的反应原理及制取Cl2的离子方程式的书写、离子检验方案的设计、基本实验仪器的识记,
考查考生实验分析能力、盐类水解知识的综合运用能力和化学计算的能力
解析:(1)仪器B是圆底烧瓶,其中发生的反应为:MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2C1-
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O。正确答案:圆底烧瓶、MnO2+4H++2C1-
Mn2++Cl2↑+2H2O。正确答案:圆底烧瓶、MnO2+4H++2C1-![]() Mn2++Cl2↑+2H2O。(2)C中发生的反应为:Cu+Cl2
Mn2++Cl2↑+2H2O。(2)C中发生的反应为:Cu+Cl2 ![]() CuCl2、2Fe+3Cl2
CuCl2、2Fe+3Cl2 ![]() 2FeCl3,所以生成物是CuCl2、FeCl3,①将生成的固体溶解在稀盐酸中后,制取氯化铜晶体前需要除去FeCl3,给出的五种试剂中,a、不能除去Fe3+且会引入NO3-,b、d都会引入杂质阳离子不适合, 而c、e分别可以消耗溶液中的H+使溶液pH升高,从而使得Fe3+逐渐沉淀,所以应该选ce。②当装置C中Fe反应不充分时,Fe溶解在盐酸中生成Fe2+,在用CuO或者Cu(OH)2调节溶液pH值时不能生成沉淀除去,这样制取的氯化铜晶体就会含有杂质,所以必须先将Fe2+氧化成Fe3+。所以加入双氧水的目的是将Fe2+氧化成Fe3+,便于沉降分离。③CuCl2·2H2O晶体中可能含有的杂质是由于Fe3+沉淀不完全而混入的FeCl3,检验方法是:取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。正确答案:CuCl2,FeCl3、ce 、将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离、 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。(3)CuCl2·2H2O晶体直接加热脱水时,由于Cu2+水解及HCl的挥发等原因,最终得到的是CuO,所以脱水过程中必须设法避免CuCl2的水解,“在HCl气流中加热到140℃得无水CuCl2”,可以利用体系中存在的HCl抑制CuCl2水解。正确答案:防止CuCl2水解。(4)CuCl2·2H2O
2FeCl3,所以生成物是CuCl2、FeCl3,①将生成的固体溶解在稀盐酸中后,制取氯化铜晶体前需要除去FeCl3,给出的五种试剂中,a、不能除去Fe3+且会引入NO3-,b、d都会引入杂质阳离子不适合, 而c、e分别可以消耗溶液中的H+使溶液pH升高,从而使得Fe3+逐渐沉淀,所以应该选ce。②当装置C中Fe反应不充分时,Fe溶解在盐酸中生成Fe2+,在用CuO或者Cu(OH)2调节溶液pH值时不能生成沉淀除去,这样制取的氯化铜晶体就会含有杂质,所以必须先将Fe2+氧化成Fe3+。所以加入双氧水的目的是将Fe2+氧化成Fe3+,便于沉降分离。③CuCl2·2H2O晶体中可能含有的杂质是由于Fe3+沉淀不完全而混入的FeCl3,检验方法是:取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。正确答案:CuCl2,FeCl3、ce 、将铁元素(或Fe2+)完全氧化成Fe3+),便于沉降分离、 取少量晶体加水溶解后,滴加KSCN溶液,没有出现血红色,证明晶体不含铁化合物。(3)CuCl2·2H2O晶体直接加热脱水时,由于Cu2+水解及HCl的挥发等原因,最终得到的是CuO,所以脱水过程中必须设法避免CuCl2的水解,“在HCl气流中加热到140℃得无水CuCl2”,可以利用体系中存在的HCl抑制CuCl2水解。正确答案:防止CuCl2水解。(4)CuCl2·2H2O ![]() CuCl2+2H2O;2CuCl2
CuCl2+2H2O;2CuCl2![]() 2CuCl+Cl2,因此10.26g晶体理论上可以得到CuCl:
2CuCl+Cl2,因此10.26g晶体理论上可以得到CuCl:![]() 。测定过程中,CuCl→FeCl2→Ce(SO4)2,所以实验测得每份样品中CuCl:
。测定过程中,CuCl→FeCl2→Ce(SO4)2,所以实验测得每份样品中CuCl:![]() ,则CuCl的产率为
,则CuCl的产率为![]() 。正确答案:97%。
。正确答案:97%。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据主族元素在周期表中所处的位置无法确定的是( )
A.相对原子质量B.电子层数C.最外层电子数D.核电荷数
-
科目: 来源: 题型:
查看答案和解析>>【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
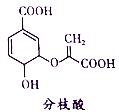
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法错误的是( )
A. 乙醇能使酸性高锰酸钾溶液褪色,被氧化生成CO2和H2O
B.
 和C4Hl0的二氯代物的数目不同(不含立体异构)
和C4Hl0的二氯代物的数目不同(不含立体异构)C. 乙烯能使溴水褪色、能使酸性KMnO4溶液褪色,它们发生反应的类型不同
D. 植物油通过氢化可以变成脂肪
-
科目: 来源: 题型:
查看答案和解析>>【题目】将4.34 g Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到672 mL混合气体,将混合气体通电后恰好完全反应,则Na、Na2O、Na2O2的物质的量之比为
A. 4∶3∶2 B. 1∶2∶1 C. 1∶1∶2 D. 1∶1∶1
-
科目: 来源: 题型:
查看答案和解析>>【题目】我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
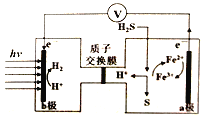
A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了除去括号内的杂质,其试剂选择和分离方法都正确的是( )
序号
物质(杂质)
所用试剂
分离方法
A
溴苯(溴)
苯
萃取分液
B
甲烷(乙烯)
溴水
洗气
C
乙烯(SO2)
酸性KMnO4
洗气
D
乙醇(H2O)
生石灰
过滤
A.A
B.B
C.C
D.D
相关试题

