【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图![]() ,苧烯的分子式为___________。
,苧烯的分子式为___________。
参考答案:
【答案】 ① 放热 -92kJ C5H12 C10H16
【解析】(1)根据反应的特点和能量变化分析解答;
(2)根据反应物总能量与生成物总能量的关系判断是放热还是吸热;反应热等于断键吸收的能量和形成化学键所放出的能量的差值;
(3)根据烷烃的通式解答;
(4)将碳、氢元素符号省略,只表示分子中键的连接情况,每个拐点或终点均表示有1个碳原子,称为键线式。
(1)①煅烧石灰石制生石灰是吸热反应;②燃烧木炭取暖是放热反应;③酸碱中和反应是放热反应;④铝粉与氧化铁粉末在高温下发生铝热反应是放热反应;⑤生石灰与水作用制熟石灰是放热反应;⑥食物因氧化而腐败的放热反应。则属于吸热反应的是①;
(2)①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,这说明反应物的总能量高于生成物的总能量,因此该反应为放热反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)![]() 2NH3(g)的反应热△H=(946+3×436-2×3×391)kJ/mol=-92kJ/mol,因此1molN2完全反应生成NH3会放出92kJ的热量。
2NH3(g)的反应热△H=(946+3×436-2×3×391)kJ/mol=-92kJ/mol,因此1molN2完全反应生成NH3会放出92kJ的热量。
(3)烷烃的通式是CnH2n+2,相对分子质量为72的烷烃,则14n+2=72,解得n=5,所以分子式为C5H12。
(4)苧烯的键线式如图![]() ,则苧烯的分子式为C10H16。
,则苧烯的分子式为C10H16。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
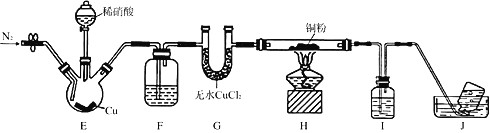
已知:在溶液中,FeSO4+NO
 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是A. 装置F、I中的试剂依次为水,硫酸亚铁溶液
B. 装置J收集的气体中不含NO
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下有浓度均为0.1 mol
 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O (1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时
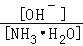 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
-
科目: 来源: 题型:
查看答案和解析>>【题目】对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)
 H= +180 kJ·mol-1;
H= +180 kJ·mol-1;2H2(g)+O2(g)=2H2O(g)
 H =-483 kJ·mol-1;
H =-483 kJ·mol-1;N2(g)+3H2(g)=2NH3(g)
 H = -93 kJ·mol-1。
H = -93 kJ·mol-1。则氨的催化氧化反应的热化学方程式为___________________________________。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如右图所示。
N2(g)+2CO2(g) △H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如右图所示。
①NO的平衡转化率为_________,0~20min平均反应速率v(NO)为_____________mol/(L
 min);该温度下的化学平衡常数数值是_____________。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________ 移动(填“向左”、“向右”或“不”)。
min);该温度下的化学平衡常数数值是_____________。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________ 移动(填“向左”、“向右”或“不”)。②下列可说明该反应已经达到平衡的是__________。
a. v生成(CO2)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.单位时间内消耗2n mol CO2的同时生成n mol N≡N
e.NO、CO、N2、CO2的浓度相等
③反应达到平衡后,改变某一个条件,下列示意图曲线①⑧中正确的是________

-
科目: 来源: 题型:
查看答案和解析>>【题目】根据图示,回答下列问题:
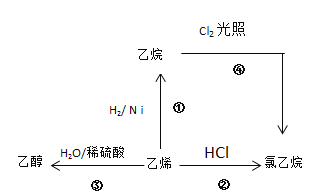
(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】Ⅰ.下表是元素周期表的一部分,根据表中列出的10种元素,回答下列问题。

(1)O和S中,原子半径较大的是________;(填元素符号或化学,以下同)
(2)CH4和NH3中,热稳定性较强的是________;
(3)新制氯水有漂白作用,是因为其中含有________;
(4)元素最高价氧化物对应水化物中,两性氢氧化物是________________;
(5)上表元素中,存放最高价氧化物对应水化物的碱性最强的溶液的试剂瓶盖不能用玻璃塞,请写出该反应的离子方程式_______________。
Ⅱ.现有部分元素的性质与原子(或分子)结构如下表:
元素编号
元素性质与原子(或分子)结构
T
最外层电子数是次外层电子数的3倍
X
常温下单质为双原子分子,分子中含有3对共用电子对
Y
M层比K层少1个电子
Z
第3周期元素的简单离子中半径最小
(1)元素T在元素周期表中的位置是________________。
(2)元素Y与元素Z相比,金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)上述四种元素中有2种元素能形成一种淡黄色的固体,该化合物的电子式是________________,所含化学键的类型有________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】锂—铜空气燃料电池(如图)容量高、成本低,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法错误的是

A. 整个反应过程中,氧化剂为O2
B. 放电时,正极的电极反应式为:Cu2O+H2O+2e-=2Cu+2OH-
C. 放电时,当电路中通过0.1 mol电子的电量时,有0.1 mol Li+透过固体电解质向Cu极移动,有标准状况下1.12 L氧气参与反应
D. 通空气时,铜被腐蚀,表面产生Cu2O
相关试题

