【题目】常温下有浓度均为0.1 mol![]() 的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
的四种溶液:①Na2CO3 ②NaHCO3 ③HCl ④NH3·H2O
(1)有人称溶液①是油污的“清道夫”,原因是_____________________(用离子方程式解释)
(2)这四种溶液中水的电离程度由大到小的顺序是(用序号填写)______________________
(3)向④中加入少量氯化铵固体,此时![]() 的值___________(填“增大”“减小”或“不变”)。
的值___________(填“增大”“减小”或“不变”)。
(4)等体积混合③和④的溶液,此时溶液中[NH4+]+[NH3·H2O]=_____________mol·L-1(填数值);此时溶液中离子浓度的大小顺序是:__________________________;若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
(5)将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________ mol·L-1。
参考答案:
【答案】 CO32-+H2O![]() HCO3-+OH- ①②④③ 减小 0.05 [Cl-]>[NH4+] >[H+]>[OH﹣] 小于 10-12
HCO3-+OH- ①②④③ 减小 0.05 [Cl-]>[NH4+] >[H+]>[OH﹣] 小于 10-12
【解析】(1)碳酸钠溶液水解显碱性,离子方程式为:CO32﹣+H2OHCO3﹣+OH﹣;(2)①Na2CO3 ②NaHCO3 盐溶液中阴离子水解促进水的电离,水的电离程度增大,碳酸根离子水解程度大于碳酸氢根离子,则水的电离程度①>②,③HCl ④NH3H2O是酸和碱,抑制水的电离,一水合氨为弱碱,等浓度时氢氧根离子浓度小于盐酸中的氢离子浓度,对水抑制程度小,水电离程度④>③,则四种溶液中水的电离程度由大到小的顺序是①②④③;(3)一水合氨溶液中存在电离平衡,加入氯化铵固体溶解后,铵根离子浓度增大,平衡逆向进行,氢氧根离子减小,一水合氨增大,比值减小;(4)等体积混合③HCl ④NH3H2O,生成氯化铵溶液,溶液中存在物料守恒,氮元素守恒,此时溶液中[NH4+]+[NH3H2O]=0.05mol/L,溶液中铵根离子水解溶液显酸性判断溶液中离子浓度大小为:[Cl﹣]>[NH4+]>[H+]>[OH﹣],若将③和④的溶液混合后溶液恰好呈中性,需要一水合氨多,一水合氨溶液体积略大,则混合前③的体积小于④的体积;(5)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的![]() ,为0.01mol/L,由Kw=c(OH﹣)c(H+)可知,c(OH﹣)=10﹣12 molL﹣1,则此时溶液中由水电离出的c(H+)=10﹣12 molL﹣1。
,为0.01mol/L,由Kw=c(OH﹣)c(H+)可知,c(OH﹣)=10﹣12 molL﹣1,则此时溶液中由水电离出的c(H+)=10﹣12 molL﹣1。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)
 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于胶体应用与其性质的对应不正确的是( )
A.鉴别胶体与浊液(丁达尔效应)
B.高压除尘(电泳现象)
C.河海交汇处可沉积沙洲(聚沉)
D.喷雾剂的应用(布朗运动) -
科目: 来源: 题型:
查看答案和解析>>【题目】某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2,排尽装置内的空气。
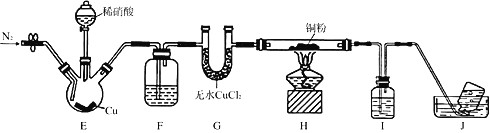
已知:在溶液中,FeSO4+NO
 [Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是
[Fe(NO)]SO4(棕色),该反应可用于检验NO。下列对该实验相关描述错误的是A. 装置F、I中的试剂依次为水,硫酸亚铁溶液
B. 装置J收集的气体中不含NO
C. 实验结束后,先熄灭酒精灯,再关闭分液漏斗的活塞
D. 若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】对含氮物质的研究和利用有着极为重要的意义。
(1)N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)=2NO(g)
 H= +180 kJ·mol-1;
H= +180 kJ·mol-1;2H2(g)+O2(g)=2H2O(g)
 H =-483 kJ·mol-1;
H =-483 kJ·mol-1;N2(g)+3H2(g)=2NH3(g)
 H = -93 kJ·mol-1。
H = -93 kJ·mol-1。则氨的催化氧化反应的热化学方程式为___________________________________。
(2)汽车尾气净化的一个反应原理为:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如右图所示。
N2(g)+2CO2(g) △H<0。一定温度下,将2.8mol NO、2.4mol CO通入固定容积为2L的密闭容器中,反应过程中部分物质的物质的量变化如右图所示。
①NO的平衡转化率为_________,0~20min平均反应速率v(NO)为_____________mol/(L
 min);该温度下的化学平衡常数数值是_____________。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________ 移动(填“向左”、“向右”或“不”)。
min);该温度下的化学平衡常数数值是_____________。25min时,若保持反应温度不变,再向容器中充入CO、N2各0.8 mol,则化学平衡将_________ 移动(填“向左”、“向右”或“不”)。②下列可说明该反应已经达到平衡的是__________。
a. v生成(CO2)= v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.单位时间内消耗2n mol CO2的同时生成n mol N≡N
e.NO、CO、N2、CO2的浓度相等
③反应达到平衡后,改变某一个条件,下列示意图曲线①⑧中正确的是________

-
科目: 来源: 题型:
查看答案和解析>>【题目】完成以下问题:
(1)下列反应中,属于吸热反应的是______________(填数字序号)。
①煅烧石灰石制生石灰 ②燃烧木炭取暖 ③酸碱中和反应
④铝粉与氧化铁粉末在高温下反应 ⑤生石灰与水作用制熟石灰 ⑥食物因氧化而腐败
(2)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能最为E2,且E1>E2,则该反应为____(“吸热”或“放热”)反应。
②已知断开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)
 2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。
2NH3(g),若1molN2完全反应生成NH3会放出________kJ的热量。(3)相对分子质量为72的烷烃的分子式为______________。
(4)有机物的结构可用“键线式”表示,如:CH3CH=CHCH3可简写为
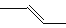 。
。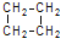 可简写为
可简写为 。玫瑰的香味物质中包含苧烯,苧烯的键线式如图
。玫瑰的香味物质中包含苧烯,苧烯的键线式如图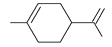 ,苧烯的分子式为___________。
,苧烯的分子式为___________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】根据图示,回答下列问题:
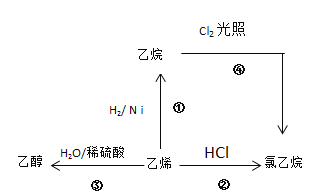
(1)按要求写出下列有机物的分子结构。
乙烯的电子式__________,
乙烷的分子式________,
乙醇的结构式___________,
氯乙烷的结构简式________。
(2)写出②、④两步反应的化学方程式,并注明反应类型
②_______________________,反应类型_______________。
④_______________________,反应类型_______________。
相关试题

