【题目】在水玻璃中通入足量的CO2气体,充分反应后,加热蒸发,再高温灼烧,则最后所得的固体物质为
A. SiO2与NaHCO3 B. SiO2与Na2CO3 C. SiO2 D. Na2SiO3
参考答案:
【答案】D
【解析】水玻璃中通入足量的CO2,发生的反应是Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,然后加热蒸发,H2SiO3分解成SiO2和H2O,高温灼烧,NaHCO3分解得Na2CO3固体,SiO2和Na2CO3生成Na2SiO3和CO2,最后固体物质是Na2SiO3,故选项D正确。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化可通过一步化学反应实现的是
A. Na2O2→Na B. Al2O3→Al(OH)3
C. SiO2→H2SiO3 D. Na2CO3→NaOH
-
科目: 来源: 题型:
查看答案和解析>>【题目】随着人们生活节奏的加快,方便的小包装食品受到青睐。为了延长食品的保质期,防止食品受潮及氧化变质,在包装袋中应放入的化学物质是
A. 无水硫酸铜、蔗糖 B. 硅胶、硫酸亚铁
C. 食盐、铁粉 D. 生石灰、食盐
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A. CO2、NO2或SO2都会导致酸雨的形成 B. 木材浸过水玻璃后,具有良好的防火性能
C. 石英坩埚、水泥、陶瓷都是硅酸盐产品 D. 氯气泄漏后,人应逆风且往低处跑
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲醇是一种化工原料,在工业生产中有重要的应用。
Ⅰ.在l.0L恒容密闭容器中投入1 molCO2和2.75molH2发生反应:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。
CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示,下列说法正确的是_______。

A.该反应的正反应为放热反应
B.压强大小关系为pl<p2<p3
c. M点对应的平衡常数K的值约为1.04×10-2
D.在p2及512K时,图中N点v(正)<v(逆)
Ⅱ.甲醇是基本有机化工原料。甲醇及其可制得的产品的沸点如下。
名称
甲醇
二甲胺
二甲基甲酰胺
甲醚
碳酸二甲酯
结构简式
CH3OH
(CH3)2NH
(CH3)2NCHO
CH3OCH3
(CH3O)2CO
沸点/℃
64.7
7.4
153
-24.9
90
(1)在425℃、Al2O3做催化剂,甲醇与氨气反应可以制得二甲胺。二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为____________。
(2)甲醇制甲醚的化学方程式为2CH3OH
 CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。
CH3OCH3+H2O,一定温度下,在体积为1.0L的恒容密闭容器中发生该反应。己知387℃时该反应的化学平衡常数K=4,若起始时向容器I中充入0.10molCH3OH、0.15molCH3OCH3和0.10molH2O,则反应将向______(填“正”或“逆”)反应方向进行。(3)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如下图所示。
电源的负极为__________(填“A”或“B”),写出阳极的电极反应_________;若参加反应的O2为1.12m3(标准状况),则制得的碳酸二甲酯的质量为______kg。
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属铁是般常用的金属之一,其铁合金及其化合物有着重要的用途。
(l)某种铁碳化合物X是炼钢的原料,经分析可知,X中铁、碳两元素的质量比为14:1,则X的化学式________;X在足量的空气中高温煅烧,生成有磁性的固体Y和能使澄消石灰水变浑浊的气体,该反应的化学方程式为___________________。
(2)铁钛合金是一种常用不锈钢材料,某同学在探究该合金性质时,往含有TiO2+、Fe3+溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
①2Fe3++Fe=3Fe2+ ②Ti3+(紫色)+Fe3++H2O=TiO2+(无色)+Fe2++2H+
③_______________________。
(3)氧化铁是重要的工业原料,用废铁屑制备它的流程如下:
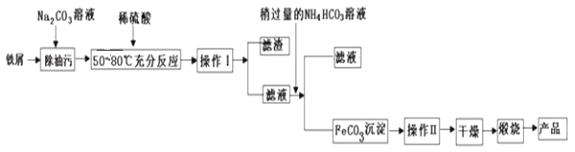
回答下列问题:
①操作Ⅱ的名称是_________。
②请完成生成FeCO3沉淀的离子方程式:_____________;FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5mol/L。试判断所得FeCO3固体是否混有Fe(OH)2:____(填“是”或“否”),请通过简单计算说明理由___________。
(已知Ksp[Fe(OH)2]=4.9×10-17mol3·L-3 、Ksp[FeCO3]=2.1×10-11mol2·L-2)
③煅烧如果不充分,产品中将有Fe2+存在,试设计实验检验产品中有无Fe2+。
_______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】[2017江苏]某科研小组采用如下方案回收一种光盘金属层中的少量Ag(金属层中其他金属含量过低,对实验的影响可忽略)。

已知:①NaClO溶液在受热或酸性条件下易分解,如:3NaClO
 2NaCl+NaClO3
2NaCl+NaClO3②AgCl可溶于氨水:AgCl+2NH3·H2O
 Ag(NH3) 2++ Cl +2H2O
Ag(NH3) 2++ Cl +2H2O③常温时N2H4·H2O(水合肼)在碱性条件下能还原Ag(NH3)2+:
4Ag(NH3) 2++N2H4·H2O
 4Ag↓+N2↑+4
4Ag↓+N2↑+4 +4NH3↑+H2O
+4NH3↑+H2O(1)“氧化”阶段需在80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO溶液与Ag反应的产物为AgCl、NaOH和O2,该反应的化学方程式为________________。 HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是__________________________________________。
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3·H2O反应外(该条件下NaClO3与NH3·H2O不反应),还因为__________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案:________________________(实验中须使用的试剂有:2 mol·L1水合肼溶液,1 mol·L1H2SO4)。
相关试题

