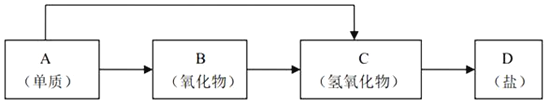
【题目】金属及其化合物的种类很多,我们可以按照“金属单质、金属氧化物、金属氢氧化物、盐”的类别进行研究。以下是元素周期表中前18号某种金属元素对应的单质及其化合物之间的转化关系(“→”所指的转化都是一步完成)。
(1)若B为呼吸面具中的供氧剂,其供氧时每生成1molO2,反应过程中转移的电子数为___________________,A与水反应的离子方程式为:_____________________。
(2)200℃时,11.6g CO2和H2O的混合物气体与足量的B反应,反应后固体增加了3.6g,则原混合物的平均相对分子质量为______________。
(3)写出一种“C→D”转化的离子方程式:___________________________________。
(4)某同学将一小块A单质露置于空气中,观察到下列现象:
银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 出现液滴
出现液滴![]() 白色固体
白色固体
则下列说法正确的是_____________________。
A.①发生了氧化还原反应
B.①变灰暗色是因为生成了过氧化钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
参考答案:
【答案】2NA 2Na+2H2O=2Na++2OH﹣+H2↑ 23.2 OH﹣+H+=H2O A
【解析】
金属单质可以形成氧化物,也可以直接生成碱,金属氢氧化物一步形成盐,解题关键在金属单质可以直接形成碱的推断。A为活泼金属K、Ca、Na等;结合常见物质及各步反应转化关系分析判断。
(1)若B为呼吸面具中的供养剂,则B是Na2O2,金属A为钠,钠与水反应生成氢氧化钠和氢气;Na2O2与水反应生成O2,过氧化钠既作氧化剂,又作还原剂,根据反应原理计算电子转移数目;
(2)根据Na2O2与水、CO2反应时的物质的量关系,用差量法先计算氧气的物质的量,再计算混合气体的物质的量,根据![]() ,计算平均摩尔质量,最后求得平均相对分子质量;
,计算平均摩尔质量,最后求得平均相对分子质量;
(3)C→D转化的反应为氢氧化钠和盐酸反应生成氯化钠和水;
(4)小块金属钠露置于空气中发生的变化中,由银白色先变灰暗,再变白色,后出现液滴,最后变为白色固体,①是钠被氧化为氧化钠;发生的反应是氧化还原反应,②是氧化钠和水反应生成氢氧化钠;③氢氧化钠潮解形成氢氧化钠溶液;④是二氧化碳和氢氧化钠反应生成碳酸钠固体。
金属单质可以形成氧化物,也可以直接一步生成碱,根据氧化物B可作为供氧剂,可确定A为活泼金属Na,B是Na2O2,C是NaOH,D是NaCl等钠盐。
(1)A为钠,若B为呼吸面具中的供氧剂,则B在供氧时主要反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2↑,其供氧时每生成1mol O2,反应过程中转移的电子数为2NA,
Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑;
(2)由反应:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,可知参加反应的CO2和H2O与生成O2的物质的量之比都是为2:1,m(增重)=m(吸收)-m(放出),即11.6g-m(O2)=3.6g,m(O2)=11.6g-3.6g=8.0g,所以n(O2)=![]() ,则n(CO2)+n(H2O)=0.5mol,则原混合气体的平均摩尔质量
,则n(CO2)+n(H2O)=0.5mol,则原混合气体的平均摩尔质量![]() ,所以原混合气体的平均式量是23.2;
,所以原混合气体的平均式量是23.2;
(3)C→D转化的化学方程式为:NaOH+HCl=NaCl+H2O,离子方程式为:OH-+H+=H2O;
(4)Na性质活泼,易与空气中氧气反应生成Na2O,Na2O易与水反应生成NaOH,NaOH吸收空气中的水和CO2生成Na2CO3xH2O,Na2CO3xH2O风化脱水生成Na2CO3。
A.①是Na发生氧化还原反应,生成了氧化钠, A正确;
B.②变暗色主要是因为Na和O2反应生成了氧化钠,B错误;
C.③是氢氧化钠潮解,吸收水蒸气形成氢氧化钠溶液, C错误;
D.④是二氧化碳和氢氧化钠反应生成碳酸钠溶液和水,水分蒸发,最后得到碳酸钠固体,发生了化学反应,D错误;
故合理选项是A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】苯丙醇异丁酸酯(
 )是一种合成香料,其中一种合成路线如图:
)是一种合成香料,其中一种合成路线如图:
已知:R-CH=CH2
 R-CH2CH2OH。请回答下列问题:
R-CH2CH2OH。请回答下列问题:
(1)A的化学名称是______________,B中含有的官能团名称是________________。(2)在一定条件下,A与水反应也可以生成B或另外一种生成物,该反应的反应类型为___________,“另外一种生成物”的结构简式为_____________________________。
(3)C可被新制的Cu(OH)2悬浊液氧化,也可以被其他氧化剂所氧化。写出C与银氨溶液反应的化学方程式:_____________________________。
(4)D的核磁共振氢谱显示为6组峰,且峰面积之比为1∶1∶1∶1∶2∶2,则D的结构简式为_______________;D的同分异构体有多种,其中苯环上有两个不含环状的取代基,并能与Na反应的同分异构体有_______种(不含立体异构)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知某市售“84消毒液”瓶体部分标签如下图所示,该“84 消毒液”通常稀释100 倍(体积之比)后使用.请回答下列问题:

(1)该“84 消毒液”的物质的量浓度约为__mol/L.( 保留小数点后 1 位)
(2)该同学参阅此“84 消毒液”的配方,欲用NaClO固体配制480mL 与市售物质的量浓度相同的“84 消毒液”,下列说法中正确的是__( 填序号).
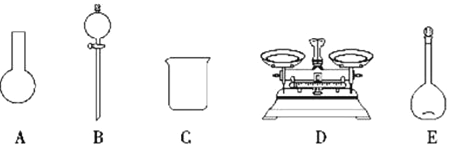
A.如下图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)“84 消毒液”与稀硫酸混合使用可增强其消毒能力,某消毒小组人员用 98%( 密度为1.84g/cm3)的浓硫酸配制 500mL 2.3mol/L 的稀硫酸用于增强“84 消毒液”的消毒能力.
①需用浓硫酸的体积为__mL.
②取用任意体积的浓硫酸时,下列物理量中不随所取体积的多少而变化的是__。
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液的质量 D.溶液的密度
③对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于2.3mol/L有__。
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面.
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法错误的是( )
A. 乙醇能使酸性高锰酸钾溶液褪色,被氧化生成CO2和H2O
B.
 和C4Hl0的二氯代物的数目不同(不含立体异构)
和C4Hl0的二氯代物的数目不同(不含立体异构)C. 乙烯能使溴水褪色、能使酸性KMnO4溶液褪色,它们发生反应的类型不同
D. 植物油通过氢化可以变成脂肪
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数的值。下列说法正确的是 ( )
A. 0.1molH218O与D2O的混合物中所含中子数为NA
B. 17g羟基所含电子的数目为10NA
C. lLpH=l的H2SO4溶液中含有的H+数目为0.2NA
D. 密闭容器中1molH2(g)与1molI2(g)共热反应制备HI增加2NA个H-I键
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列装置由甲、乙两部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法错误的是( )
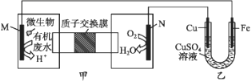
A. 甲中H+透过质子交换膜由左向右移动
B. M极电极反应式:H2N(CH2)2NH2+4H2O-16e-
 2CO2↑+N2↑+16H+
2CO2↑+N2↑+16H+C. 一段时间后,乙中CuSO4溶液浓度基本保持不变
D. 当N极消耗0.25 mol O2时,则铁极增重16 g
相关试题

