(2011•宝鸡一模)下表中实验操作能达到实验目的或得出正确结论的是( )
|
参考答案:
分析:A.SO2与溴水发生氧化还原反应;
B.应在碱性条件下与新制Cu( OH)2反应;
C.溴与NaOH反应而被吸收;
D.Cu2+只具有氧化性.
B.应在碱性条件下与新制Cu( OH)2反应;
C.溴与NaOH反应而被吸收;
D.Cu2+只具有氧化性.
解答:解:A.SO2与溴水发生氧化还原反应,不是表现出的漂白性,故A错误;
B.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与与新制Cu( OH)2在碱性条件下反应,故B错误;
C.溴苯和水互不相溶,溴与NaOH反应而被吸收,然后分液可制得溴苯,故C正确;
D.Cu2+只具有氧化性,电解的证明氧化性Cu2+比Fe2+强,故D错误.
故选C.
B.淀粉在酸性条件下水解生成葡萄糖,葡萄糖与与新制Cu( OH)2在碱性条件下反应,故B错误;
C.溴苯和水互不相溶,溴与NaOH反应而被吸收,然后分液可制得溴苯,故C正确;
D.Cu2+只具有氧化性,电解的证明氧化性Cu2+比Fe2+强,故D错误.
故选C.
点评:本题考查化学实验的评价,题目难度中等,注意把握相关物质的性质,为解答该类题目的关键.
-
科目: 来源: 题型:阅读理解
查看答案和解析>>(2011•宝鸡一模)Ⅰ.氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: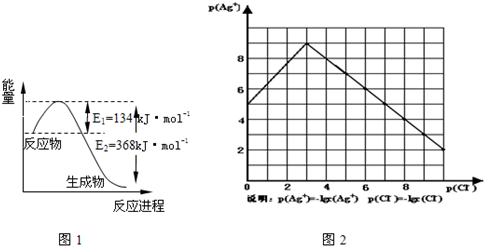
(1)图1是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和 CO反应的热化学方程式NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,其化学平衡常数K与温度t的关系如表:请完成下列问题;t/℃ 200 300 400 K K1 K2 0.5
①试比较K1、K2的大小,K1>>K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是cc(填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.υ(N2)(正)=3υ(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
③400℃时,反应2NH3(g)⇌N2(g)+3H2(g)的化学平衡常数的值为22.当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的
υ(N2)(正)>>υ(N2)(逆) (填写“>”、“=”或“<”=)
Ⅱ.沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合
物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,图2是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为10-1210-12.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色.
(4)若在AgCl形成的浊液中滴加氨水有什么现象?白色沉淀溶解,形成无色溶液白色沉淀溶解,形成无色溶液.发生反应的离子方程式为AgCl+2NH3=Ag(NH3)2++Cl-AgCl+2NH3=Ag(NH3)2++Cl-. -
科目: 来源: 题型:
查看答案和解析>>(2011•宝鸡一模)有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含有一种阴离子且互不重复)
已知:①A、C溶液J pH'均大于7,相同浓度的A、B的溶液中水的电离程度相同;②C溶和D溶液相遇只生成白色沉淀,B溶液和c溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象.阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO-、Cl-、OH-、SO42-
(1)A是CH3COONaCH3COONa,B是NH4ClNH4Cl,C是Ba(OH)2Ba(OH)2,D是Na2SO4Na2SO4.(写化学式)
(2)写出C和D反应的离子方程式Ba2++SO42-=BaSO4↓Ba2++SO42-=BaSO4↓
(3)25℃时,0.1mol•L-1B溶液的pH=a,则8溶液中c(H+)-c(NH3•H2O)=10 a-1410 a-14(用含有a的关系式表示).
(4)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序为c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+)c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+).
(5)在一定体积的0.005mol•L-1的C溶液中,加入一定体积的0.00125mol.L-1的盐酸时,混合溶液的pH=11著反应后溶液的体积等于C溶液与盐酸的体积之和,则C溶液与盐酸的体积比是1:41:4. -
科目: 来源: 题型:阅读理解
查看答案和解析>>(2011•宝鸡一模)某化学研究小组同学认为NH3中N元素处于最低价,得出NH3应具有还原性的结论,并设计了如下实验装置进行研究(夹持装置未画出)
请回答下列问题:
(1)写出实验室用NH4C1制取NH3化学方程式2NH4Cl+Ca(OH)4
CaCl2+2NH3↑+2H2O△ .2NH4Cl+Ca(OH)4.
CaCl2+2NH3↑+2H2O△ .
(2)该实验中的A部分的装置是下图中的ff(填写装置的序号).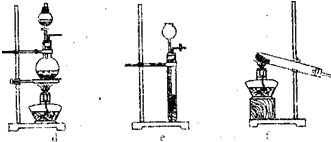
(3)试验中观察到CuO变成红色物质,无水硫酸铜变蓝色,同时生成一种无色无味的且组成为双原子分子的气体,说明'Cu0能被NH3还原,该反摩的化学方程式是3CuO+2NH3
3Cu+N2+3H2O△ .3CuO+2NH3.
3Cu+N2+3H2O△ .
(4)该小组同学在此实验中设计上存在一定的缺陷,为保证实验结果的准确性,请你帮助该小组同学提出改进措施在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验在A和B之间增加一个装有碱石灰的干燥管,在C装置后再接一个装有浓硫酸的洗气瓶来吸收多余的氨气并防止外界水蒸气进入影响实验.
(5)某同学通过查阅资料得知:Cu2O也是红色碱性氧化物,在酸性溶液中,Cu+的稳定性比Cu2+差,且在酸性条件下易发生反应:Cu+→+Cu2+→+Cu.于是提出(3)中得到的红色物质可能是Cu或Cu2O或Cu与Cu2O的混合物,需要进_步验证红色物质的成分,请你设计一个简单实验来验证NH.和Cu0反应生成的红色物质中是否含有Cu2O. -
科目: 来源: 题型:
查看答案和解析>>(2011•宝鸡一模)化学选修3-物质结构与性质
元素X和Y属于同一主族.负二价的元素X和氢的化合物在通常情况下是一种液体,其中X的质量分数为88.9%;元素X和元素Y可以形成两种化合物M和N,在M和N中,Y的质量分数分别为50%和40%.
(1)与X、Y同主族且与Y相邻的Z元素在周期表中的位置为第四周期ⅥA族第四周期ⅥA族,Z的基态原子删除此空删除此空的价层电子的排布式为4S24P44S24P4.(2分)
(2)M化学式为SO2SO2;该分子是由极性极性键(填“极性”或“非极性”)形成的极性极性分子(填“极性”或“非极性”).
(3)写出与N互为等电子体的一种分子的化学式_BF3BF3;该分子中的中心原子以SP2SP2杂化,是非极性非极性分子(填“极性”或“非极性”),分子空间构型为平面三角形平面三角形.
(4)由元素氢、X、Y三种元素形成的他合物常见的有两种.其水溶液均显酸性,试分别写出其分子式H2SO4H2SO4、H2SO3H2SO3,并比较酸性强弱:H2SO4>H2SO3H2SO4>H2SO3.
相关试题

